(本小题14分)氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛。
(1)图中表示两个常见的固氮反应:
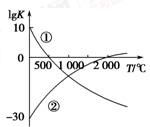
①N2+3H2 2NH3
2NH3
②N2+O2 2NO的平衡常数(lg K)与温度的关系,
2NO的平衡常数(lg K)与温度的关系,
根据图中的数据判断下列说法正确的是________(填序号)。
| A.反应②为放热反应 |
| B.常温下,反应①的反应速率很大,而反应②的反应速率很小 |
| C.升高温度,反应①的反应速率增大,反应②的反应速率减小 |
| D.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大 |
(2)工业上也可在碱性溶液中通过电解的方法实现由N2制取NH3:2N2+6H2O 4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ___。
4NH3+3O2,通入N2的一极是________(填“阴极”或“阳极”),阳极的电极反应式是____ ___。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应:
①N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+ O2(g) ΔH=a kJ/mol。
O2(g) ΔH=a kJ/mol。
已知:②N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,
2NH3(g) ΔH=-92.4 kJ/mol,
2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
2H2O(l) ΔH=-571.6 kJ/mol,则a=__________。
(4)已知:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
2N2(g)+6H2O(g) ΔH=-1316 kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
①当温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填代号)。

②该燃料电池的负极反应式是____________。
(5)工业上合成氨时,温度过高,氨气的产率降低,试从化学平衡移动原理的角度加以解释:_____________。
(1)AlCl3溶液与NaOH溶液反应时,当Al3+的物质的量与OH-的物质的量之比(以下均填物质的量之比)为________时,Al(OH)3沉淀量最多。
(2)NaAlO2溶液与盐酸溶液反应时,AlO的物质的量与H+的物质的量之比为________时,Al(OH)3沉淀恰好溶解。
将V mL NO和NO2的混合气体通过足量的水,充分反应后,得到一定体积的无色气体A。将此无色气体A与等体积的氧气混合,充分反应后,再通过足量的水,充分反应后还能收集到5 mL无色气体(以上气体体积均在相同状况下测定)。试回答:
(1)A是 ,其体积为 mL。
(2)反应过程中涉及的化学方程式:
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者 后者(填“<”、“>”或“=”).
(2)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸”,“中”或“碱”下同),溶液中 c(Na+ ) c(CH3 COO- )(填“ >” 或“=”或“<”,下同 )。
(3)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,溶液中c(Na+) c(CH3COO- )
(4)用Al2(SO4)3 与NaHCO3 溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式___________。
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2 的含量及有效地开发利用CO2 ,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,
在体积为1 L的密闭容器中,充入1mol CO2 和3mol H2 ,一定条件下发生反应:
CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2 和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 v (H2 )=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使 n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2 和3molH2 |
(2)①在载人航天器的生态系统中,不仅要求分离去除CO2 ,还要求提供充足的O2 。某种电化学装置可实现如下转化:2CO2 =2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH— —4e— =O2↑+2H2O
则阴极反应式为:____________________________。
②有人提出,可以设计反应2CO=2C+O2 (△ H >0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:_________;____________________________________。
课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是 (正极或负极)。
(2)甲装置中电解反应的总化学方程式是 。
(3)如果收集乙装置中产生的气体,两种气体的体积比是 。
(4)欲用丙装置给铜镀银,G应该是 (填“铜”或“银”),电镀液的主要成分是 (填化学式)。
(5)装置丁中的现象是_____________________