[选修3—物质结构与性质]钒是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个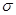 键。
键。
(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
实验室用右图所示的装置制取溴乙烷。在试管I中依次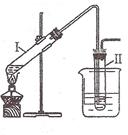
加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠
粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管
I至微沸状态数分钟后,冷却。
试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 _______。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _______(任写两种结构简式)。
(3)设计实验证明试管Ⅱ收集的溴乙烷中含有溴元素,完成以下实验报告:
| 实验步骤 |
实验操作 |
预期现象和结论 |
| 1 |
_______ |
_______ |
| 2 |
_______ |
_______ |
| 3 |
_______ |
_______ |
| 4 |
_______ |
_______ |
(4)设计实验方案,检验溴乙烷与NaOH乙醇溶液发生消去反应后生成的气体X中是否含乙烯。在答题卡对应的方框中画出实验装置图,并注明所用试剂的名称。
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。
356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为 _______。
(2)某种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-。
已知该电池负极的电极反应为:C4H10+2O2--4e-=CO2+H2O,则该电池正极的电极反应式为 _______,电池工作时,固体电解质里的O2-向 _______极移动。 (3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
(3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表: T℃时物质的浓度(mol/L)变化
| 时间 / min |
CO |
H2O(g) |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
0.100 |
0.200 |
0.100 |
0.100 |
| 4 |
0.100 |
0.200 |
0.100 |
0.100 |
| 5 |
0.116 |
0.216 |
0.084 |
C1 |
| 6 |
0.096 |
0.266 |
0.104 |
C2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 _______,第5~6min之间,改变的条件是 _______。T℃时该化 学反应的平衡常数是 _______。
②已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 _______。
③397℃时该反应的平衡常数为12,请判断该反应的△H _______0(填“>”、“=”、“<”).
铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为 _______。电解粗铜制取精铜,电解时.阳极材料是 _______,电解液中必须含有的阳离子是 _______。
(2)在100 mL 18 mol/L浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4< __mol。
(3)电子工业曾用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重薪得到FeCl3溶液,设计如下实验流程。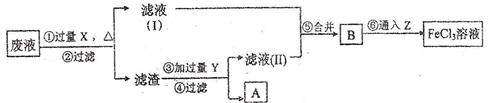
上述流程中,所加试剂的化学式为:X _______,Y _______Z _______;第⑥步反应的离子方程式为 _______。
2007年徐州市区空气质量良好以上天数达到了312天,成为近年来“蓝天”最多的一年。作为产煤较多和机动车数量快速增长的地区,徐州市区空气中二氧化硫和氮氧化物含量控制的任务依然艰巨。请回答下列问题: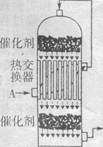

(1)燃烧化石燃料排放的烟气中含有NOX和S02。含有碱的黄磷乳浊液能够同时去除NOX和S02,这是由美国科学家研发的,命名为
PhoSNOx法。在该方法最后阶段NO2--与HSO3--反应生成(NH4)2SO4
其离子方程式为。
(2)工业上将S02转化为SO3是在接触室(如右图)里进行的,中部是一个热交换器,它是用导热性能好的管状材料制成。温度低的气体A从管外流过;经上层催化反应后的热气体从管内流过,通过导热材料进行气体与气体的热交换。中学化学实验中也有许多需要进行热交换,下列实验中需要进行热交换的(直接加热除外)是(填字母)。
| A.粗盐的提纯 | B.实验室制取少量蒸馏水 |
| C.测定中和反应过程中溶液pH的变化 | |
| D.制取乙酸乙酯 E.酚醛树脂的制取 |
(3)一定条件下,N02和S02很容易发生反应生成NO和SO3(g)。现将
NO和S02的混合气体通入容积为50 ml的容器中,充满后用带有导
管的塞子密封,则再向该容器中通入O2的体积V在mL范
围内才能保持容器内的压强不变(设气体体积均在相同条件下测定,
且不考虑NO2转化为N204)。
(4)将盛有x molNO和y mol NO2的混合气(标准状况)的试管倒扣在足量
的水中,通入O2可以使水充满试管。请在右面的坐标图中大致画出不
断通人氧气的过程中溶液的pH与V(O2)的关系曲线(设生成的硝酸均在试管内)。
(1) 组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链。它完全燃烧时所消耗O2的体
积是同状况下该烃蒸气体积的8.5倍,由此分析回答:
①若该烃为链状二烯烃,并且与等物质的量的Br2加成后只能得到单一产物,请写出化学反应方程式: (有机物用结构简式表示)。
②若该烃只能与等物质的量的Br2发生加成反应,则其结构简式为 (填任一种)。
(2) 有机物A由于其特殊的结构,一直受到理论化学家的注意,由于缺乏有效的合成途径,一度
延缓对它的研究,直到1993年出现了可以大量制备的方法,才得以被重视。A是非极性分子,
化学式是C6H8,分子的核磁共振氢谱图显示只有一个吸收峰。
①A的结构简式为 ;A分子中在同一平面上的碳原子数为 。
②A的二氯取代产物的异构体有 种。