2015年8月12日晚天津开发区化工厂发生爆炸事故。化工厂里面有各种危险化学品,其中有一种叫电石的固体,其主要成分为碳化钙(CaC2),可与水反应生成可燃性气体乙炔(C2H2),十分危险,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【作出猜想】猜想一:CaO;
猜想二: ;
猜想三:Ca(OH)2。
进行上述猜想的依据是 。
【交流与反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是 (用化学方程式说明)。
【进行实验】(一)取少量白色固体放入试管中,滴入稀盐酸,没有观察到 ,证明猜想二不成立。
(二)取少量白色固体加入水中,取上层清液,加入 ,有白色沉淀出现,证明猜想三成立。碳化钙与水反应的方程式为 。
草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O  CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。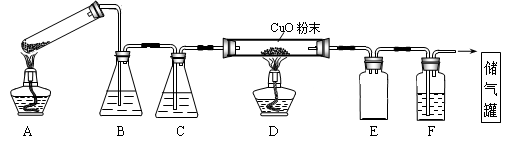
(1)A装置为加热分解草酸的装置,该装置错误是______________,C装置中盛放的试剂是______ _ ,E装置的作用是__________ 。
(2)实验过程中涉及到如下操作:①点燃A处的酒精灯 ②熄灭A处的酒精灯 ③点燃D处的酒精灯 ④熄灭D处的酒精灯。这4步操作由先到后的顺序为________ (填序号)。点燃D处酒精灯前必须要进行的操作名称是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.26g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:
2MnO4-+5H2C2O4+6H+ = 10CO2+2Mn2++8H2O。
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有_____________。
② x=________。
某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:
i.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;
[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色) + nH2O  [Fe(H2O)6-n(OH)n]3-n(黄色) + nH3O+(n = 0~6) ;
[Fe(H2O)6-n(OH)n]3-n(黄色) + nH3O+(n = 0~6) ;
ii.[FeCl4(H2O)2]-为黄色。
进行实验:
【实验I】
【实验II】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。

图1图2
Fe(NO3)3溶液透光率随温度变化曲线FeCl3溶液透光率随温度变化曲线
(1)实验I中,试管②溶液变为无色的原因是 。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是 。
(3)由实验II图1、2可知:加热时,溶液颜色 (填“变浅”、“变深”或“不变”)。
(4)由实验II,可以得出如下结论:
[结论一] FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]- + 4H2O  [Fe(H2O)6]3+ + 4Cl-,得出此结论的理由是 。
[Fe(H2O)6]3+ + 4Cl-,得出此结论的理由是 。
[结论二] 结论一中反应的ΔH (填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液, (请描述必要的实验操作和现象)。
葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
乙酰苯胺为无色晶体,有“退热冰”之称。其制备原理为:
已知:①苯胺易被氧化;②苯胺、醋酸和乙酰苯胺的部分物理性质如下表:
| 试剂名称 |
熔点℃ |
沸点℃ |
溶解度(20 ℃) |
| 苯胺 |
-6.2 |
184.4 |
稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 |
16.7 |
118 |
易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 |
114~116 |
280~290 |
0.46g |
制备乙酰苯胺的实验步骤如下:
步骤1:在下图1装置的圆底烧瓶中,加入6.0 mL苯胺、9.0 mL冰醋酸及0.2g锌粉。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,抽滤,洗涤,得到粗产品。
步骤4:通过重结晶提纯粗产品后,获得无色片状晶体,干燥后得目标产品。
图1图2
(1)仪器a的名称为 。
(2)步骤1中加入锌粉的作用是 。
(3)步骤2中控制温度计示数约105 ℃的原因是 。
(4)步骤3中,抽滤装置如图2所示,仪器c的名称是 ,当过滤的溶液具有强酸性、强碱性或强氧化性时要用 代替布氏漏斗,停止抽滤时的操作为 。
以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定Mg2+含量:将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
(1)30.00mL 5.00 mol·L-1的稀硫酸至少能溶解原料的质量为 。
(2)加入H2O2时反应的离子方程式为 。
(3)已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12。
室温下,若溶液中c(Mg2+)=0.01mol·L-1,欲使溶液中的c(Fe3+)≤1×10-6mol·L-1,需调节溶液pH范围为 。
(4)常采用下列方法测定结晶硫酸镁中Mg2+的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)形成配合物
②在pH为5~6时,Zn2+除了与EDTA反应,还能将Mg2+与EDTA形成的配合物中的Mg2+“置换”出来: Zn2+ +MgH2Y=ZnH2Y+Mg2+
步骤1:准确称取得到的硫酸镁晶体1.50g加入过量的EDTA,配成100mL pH在9~10之间溶液A
步骤2:准确移取25.00mL溶液A于锥形瓶中,用0.10mol·L-1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00mL
步骤3:准确移取25.00mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.10mol·L-1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为30.00mL。
计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程) 。