某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是 ,试剂a是 (填化学式)。
(2)加入试剂b所发生反应的化学方程式为 。
(3)用分离出的固体B配制100mL 0.5mol/L的溶液B,现有可供选择的仪器:
| A.胶头滴管; |
| B.烧瓶; |
| C.烧杯; |
| D.药匙; |
E.量筒;
F.托盘天平
回答下列问题:
①用托盘天平称得固体B的质量是 g。
②配制溶液B时,上述仪器中一定不需要使用的有 (填字母),还缺少的仪器有 (写仪器名称)。
③如下情况使所配溶液B的物质的量浓度偏高的是 。
a.某同学在定容观察液面时俯视
b.容量瓶清洗后没有干燥
c.在移液时不慎有少量液体流到容量瓶外
实验室用浓盐酸和二氧化锰共热制取氯气,现要制取一瓶干燥纯净的氯气,并防止剩余氯气逸出污染空气。现有下列仪器和药品可供使用:
(1)写出实验室用浓盐酸和二氧化锰制取氯气的化学反应方程式:【二氧化锰转变为氯化锰】;
(2)连接上述仪器的正确顺序是(填各接口处的字母)
A接,接,接G, H接D。
(3)气体尾气吸收装置中反应的化学方程式为。
(4)在装置中:a.饱和食盐水的作用是;
b.浓硫酸的作用是;
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时必需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】如下图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
(1)洗气瓶C中导管末端连接一个多孔球泡D,其目的是______________________________。
(2)洗气瓶C中的溶液还可以用其他试剂代替,如酸性高锰酸钾溶液,你认为选择酸性高锰酸钾溶液的理由有________________________________________________________。
(3)洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。若某实验小组同学测得的SO2含量总是偏低,可能的原因是__________________________________________________。(假设实验装置、测量仪器、药品和实验操作程序均合理)
【乙方案】:实验步骤如下面流程图所示:
(4)写出步骤②中反应的化学方程式____________________________________________。
(5)步骤③中判断沉淀已经洗涤干净的方法是_______________________________________。
(6)实验中若通过的尾气体积为33.6L (已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该尾气中二氧化硫的含量是否达到排放标准(写出计算过程)。
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证 卤族元素性质的递变规律。图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称:A____________,B__________,C____________;
(2)甲同学设计的实验中所涉及反应的离子方程式分别为___________________________________________________;
________________________________________________________________________。
(3)乙同学的实验原理是______________________________________________。
写出B处的离子方程式: ___________________________________________________。
今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用mL容量瓶。
(2)称量时将NaOH放在__________中,用托盘天平称取g。
(3)若实验时遇到下列情况,将会使所配的溶液浓度发生什么变化(填“偏高”、“偏低”或“无影响”):
A.加水定容时超过刻度线 ;
B.没有将洗涤液转入容量瓶中;
C.容量瓶内壁沾有水滴没有烘干就进行配制;
D.定容时俯视;
(4)选择下列实验方法分离物质,将分离方法的序号填在横线上
A.过滤 B.渗析 C.蒸发结晶 D.蒸馏
①______分离饱和食盐水与沙子的混合物。
②______从硝酸钾和氯化钠的混合液中获得硝酸钾。
某同学应用如下所示装置研究物质的性质。其中气体C的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题: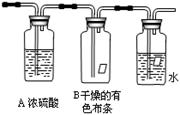
(1)该项研究的主要目的是探究氯气与水反应后生成的物质具有性。
(2)浓硫酸的作用是。
(3)观察到的实验现象是B中,C中。
(4)从物质性质方面来看,这样的实验设计还存在事故隐患,事故表现在。要克服该事故隐患,选择的操作是下图的,
并写出与解决隐患相关的离子方程式表示:。