【化学——选修3:物质结构与性质】A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。回答下列问题:
(1)D原子的核外电子排布式为 ,E的价层电子轨道示图为______________。
(2)单质B有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;
(3)A、B、C中第一电离能最大的是________(填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是 。
(4)化合物D2B的立体构型为 ,单质D与湿润的Na2CO3反应可制备D2B,其化学方程式为 .
(5)E与C所形成化合物晶体的晶胞如图所示。
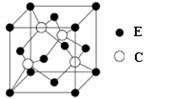
①在1个晶胞中,E离子的数目为 。
②该化合物的化学式为 。
有一化学反应2A  B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
(1)在实验1,反应在0至20分钟时间内A的平均速率为_______mol/(L·min)。
(2)在实验2,A的初始浓度C2=____________mol/L,可推测实验2中隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3v1(填>、=、<=,)800℃时,反应平衡常数=,且C3=_______mol/L,可推测实验3中隐含的条件是___________。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为mol/L, B的转化率=。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为mol/L, B的转化率=。
在如图所示的三个容积相同的三个容器①、②、③进行如下的反应:3A(g)+B(g) 2C(g)△H<0
2C(g)△H<0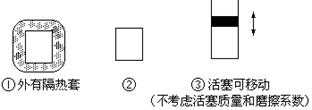
(1)若起始温度相同,分别向三个容器中充入3mol A和1mol B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号)
(2)若维持温度不变,起始时②中投入3mol A、1mol B; ③中投入3mol A、1mol B和2mol C,则达到平衡时,两容器中B的转化率②③(填<、>或=)
(3)若维持②③容器内温度和压强相等,起始时在②中投入3molA和1molB,在③中投入amol A和bmol B及cmol C,欲使达平衡时两容器内C的百分含量相等,则两容器中起始投料量必须满足(用含a、b、c的关系式表达):
食盐是日常生活的必需品,也是重要的化工原料。用提纯的NaCl配制250mL 2.00 mol·L-1 NaCl溶液。
①所用定容仪器的名称和规格为。
②计算后,需称出NaCl质量为___________g。
③下列操作的正确顺序是(用字母表示) B→ → → → → →G 。
A摇匀 B.称量 C.洗涤 D.定容 E.溶解 F.移液 G.装瓶
④下列操作对所得溶液浓度有何影响, 在横线上填写“偏高”“偏低”或“无影响”。
A 定容时仰视容量瓶刻度线:。B 称量时砝码生锈:。
(4分)就有关物质的分离回答下面的问题 (1)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/oC |
沸点/oC |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是:
(2)在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。答:
(每空2分共14分) (1)48g氧气和48g臭氧(O3),它们所含的原子数_______ (填“相同”或“不同”)它们在同温同压下的体积比是___________。0.2 mol NH3分子与____________个CH4含有的电子数相同,与_______g H2O含有的氢原子数相同,与标准状况下_______L CO含有的原子数相等。
(2)已知CO、CO2的混合气体质量共15g,标准状况下体积为8.8L,则可推知该混合气体中含CO______g,所含CO2在标准状况下的体积为______________L。