有一化学反应2A  B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在三种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
(1)在实验1,反应在0至20分钟时间内A的平均速率为_______mol/(L·min)。
(2)在实验2,A的初始浓度C2=____________mol/L,可推测实验2中隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,)800℃时,反应平衡常数= ,且C3=_______mol/L,可推测实验3中隐含的条件是___________。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0, 达到平衡时A的浓度为 mol/L, B的转化率= 。
聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。
本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下: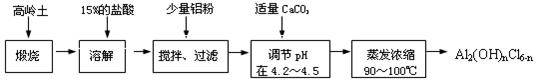
回答下列问题:
(1)“煅烧”的目的是。
(2)“溶解”过程中发生反应的离子方程式为
(3)加少量铝粉的主要作用是。
(4)“调节pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是;“蒸发浓缩”需保持温度在90~100℃,控制温度的实 验方法是。
验方法是。
(16分) 硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI 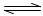 H2+I2
H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是。
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=。该温度下,H2(g)+I2(g)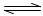 2HI(g)的平衡常数K=。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则是原来的2倍。
2HI(g)的平衡常数K=。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则是原来的2倍。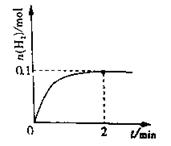
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡移动(填“向左”“向右”或“不”);若加入少量下列试剂中的,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知 2H2(g)+O2(g)====2H2O(l)△H=-572kJ·mol-1
某氢氧燃料电池释放22.8kJ电能时,生成1mol液态水,该电池的能量转化率为。
M是生产某新型塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图,所示(图中球与球之间连线代表化学键单键或双键)。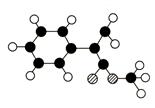
拟从芳香烃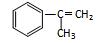 出发来合成M,其合成路线如下:
出发来合成M,其合成路线如下:
已知:M在酸性条件下水解生成有机物F和甲醇。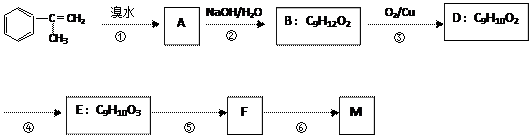
(1)根据分子结构模型写出M的结构简式
(2)写出②、⑤反应类型分别为、
(3)D中含氧官能团的名称为,E的结构简式
(4)写出反应⑥的化学方程式(注明必要的条件)。
(14分)高分子材料M在光聚合物和金属涂料方面有重要用途,M的结构简式为: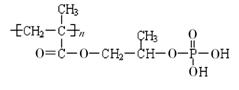
工业上合成M的过程可表示如下: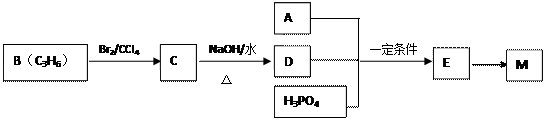
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、O原子个数比为3:1。它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是。
(2)下列说法正确的是(填序号字母)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D在水中的溶解性很大,遇新制Cu(OH)2悬浊液, 溶液呈绛蓝色
d.E→M的反应是缩聚反应
(3)写出A+D+H3PO4→E反应的化学方程式:,该反应类型是反应。
(4)F是A 的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。存在下列转化关系: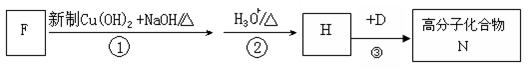
写出F、N的结构简式F:N:。
写出反应①的化学方程式。
(15分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。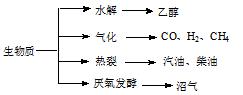
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g) △H= -90.8kJ·mol-1。
CH3OH(g) △H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
| 平衡常数 |
K1 |
K2 |
K3 |
| 反应物转化率 |
α1 |
α 2 |
α3 |
下列说法正确的是。
a. c1=c2 b. 2Q1=Q3 c. K1=K3 d. α2+ α3<100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g)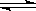 CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。平衡时n(CH3OCH3)=mol。
②下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。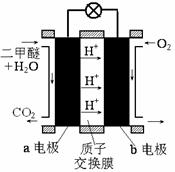
b电极是极;a电极的反应式为。