(两个选项符合题意,6分)双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是( )
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗4 mol H+ |
| D.该药剂不适合于胃溃疡患者服用 |
18-II(14分)铝是现今人类生产生活中使用广泛性仅次于铁的重要金属。工业上常以“钒土矿”为原料来冶炼金属铝。已知:钒土的主要成分是Al2O3(其中含有Fe2O3、SiO2等杂质)。为了检测某“钒土矿”样中Al2O3的含量,进行了如下实验过程:
①取矿样10.0 g加入过量稀盐酸溶解(假定其他未知成分的杂质都不溶于盐酸,也不和盐酸反应),过滤弃去不溶残渣。
②将滤液稀释并在250 mL容量瓶中定容后,取25.0 mL逐滴滴加2.5 mol·L-1的NaOH溶液,得到如图所示的变化关系。请根据有关数据回答下列问题:
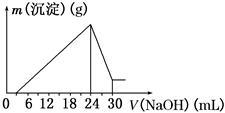
(1)写出滴加NaOH溶液0~3 mL时发生反应的离子方程式:________________。
(2)最后所得不溶于NaOH溶液的沉淀的化学式为______,其物质的量为____________。
(3)该钒土矿样中Al2O3的质量分数为________。
(4)用10.0 t“钒土矿”样提纯所得的Al2O3(提纯过程的损耗忽略不计)进行电解,理论上在 极(填“阴”,“阳”)最多可制得金属铝________t。
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题, 选学《有机化学基础》模块的考生.答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》:
(1)、(4分)良好的生态环境可以提升生活质量。
①提倡“光盘行动”,有利于“勤俭节约”、减少厨余垃圾,厨余垃圾的标识为_(填宇母)。
②下列物质中,不能用于饮用水杀菌消毒的是_(填字母)。
a.漂白粉b.乙醇c.二氧化氯
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是_(填字母)。
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金厲离子
c.用氯气除去废水中的悬浮物
④某地区各空气污染物指数为S0278、NO2 43、可吸入颗粒物153。该地K的首要污染物为_ 。
(2)、(6分)保证食品安全,合理用药,是人体健康的基础。
①营养平衡、科学使用食品添加剂有助于健康和提髙免疫力。下列物质常用作食品防腐剂的是_(填字母)。
a.苯甲酸钠 b.味精c.柠橡黄
②下列药品属F国际奥委会严格禁止的兴奋剂是_(填字母)。
a.阿司匹林 b.青霉素 c.吗啡
③氨基酸分子中含有的官能团是氨基(一NH2)和_(写名称)。人体中共有 20多种氨基酸,其中人体自身_(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
④如何检验糖尿病患者的尿液中含有葡萄糖?写出实验操作方法、现象和结论:_
(3)、(5分)化学与材料密切关联。
①下列塑料可用作不粘锅的表血材料的是(填字母)。
a.聚氯乙烯b.聚四氟乙烯 c.有机玻璃
②下列关于铁制品保护措施的说法中不正确的有(填字母)。
a.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
b.将不锈钢制成刀其和餐具,有的刀具还进行烤蓝处理
c.在海轮的外壳上常焊有铜块,且定期更新
③钢筋泡凝土属于材料。(填字母)
a.复合材料b.无机非金属材料c.金属材料
④氧气和四氯化硅蒸气在旋转的岛温炉中发生罝换反应,其产物之一可制得光导纤维,试写出该反应的化学方程式。
(12分)从物质X出发有如下图所示的一系列变化。已知X为酸式盐,A、C为无色气体,反应的某些产物已经略去。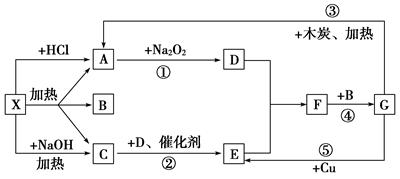
(1)写出下列物质的化学式:X:___________________________________________;
G:____________________。
(2)写出反应②的化学方程式:__________________________________________________。
(3)向X的溶液中加入过量的NaOH溶液,并加热,写出该反应的离子方程式:
_______________________________________________________________________。
(4)反应④中氧化剂与还原剂的质量之比为____________________________。
(10分)按照一定标准,根据物质与水反应的不同情况,对下列物质进行分类,如图所示,请填空:
(1)上图中分类标准1(分成A、B组的依据)为_______________________________。
(2)工业上常用D组中________(填化学式),来消除C组中物质对大气的污染,该反应的化学方程式为_____________________________________________________。
(3)实验室由Al3+制备Al(OH)3时,应选择D组中________(填化学式)的水溶液,离子方程式为__________________________________________________________________。
(4)F组中有两种物质,在工业上均有重要的用途,请各写出一个化学方程式表示其用途:
________________________________________________________________________;
________________________________________________________________________。
(10分)(1)下列实验方法合理的是________。
| A.用加热法除去食盐固体中的氯化铵 |
| B.将碘的饱和水溶液中的碘提取出来,可用酒精进行萃取 |
| C.实验室制取Al(OH)3:往AlCl3溶液中加入NaOH溶液至过量 |
| D.往FeCl2溶液中滴入KSCN溶液,检验FeCl2是否已氧化变质 |
(2)SiO2广泛存在于自然界中,其用途也非常广泛,可用于制造光导纤维,也用于生产半导体材料硅。写出工业上用石英制备粗硅的化学反应方程式
________________________________________________________________________。
(3)铝是一种重要金属:铝与NaOH溶液反应的离子方程式为:
________________________________________________________________________。
(4)将10.7 g氯化铵固体与足量消石灰混合加热使之充分反应。生成气体在标准状况下的体积是________L。
已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分解:
PbO2→Pb2O3→Pb3O4→PbO。
现将amol PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2。加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y mol。
试回答下列问题:
(1)试写出Pb2O3与浓盐酸反应的化学方程式__________________________
(2)通过计算确定y与a、x的函数关系式____________________
(3)若两步反应中O2和Cl2的物质的量之比为5∶3,则剩余固体中含有的物质为___;其物质的量之比为________________。