A~J均为有机化合物,它们之间的转化如下图所示。
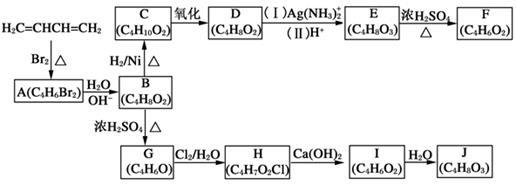
实验表明:
①D既能发生银镜反应,又能与金属钠反应放出氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;[
④I中有两个环状结构;
⑤1 mol J与足量金属钠反应可放出22.4 L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为 (不考虑立体异构),由A生成B的反应类型是 反应;
(2)D的结构简式为 ;
(3)由E生成F的化学方程式为 ,与E具有相同官能团的E的同分异构体除了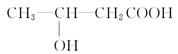 和
和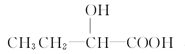 以外,还有 、 (写出结构简式,不考虑立体异构)。
以外,还有 、 (写出结构简式,不考虑立体异构)。
(4)G的结构简式为 ;
(5)由I生成J的化学方程式为 。
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是,C2B2的电子式为。
(2)B、C、D、F的离子半径由大到小的顺序是(用离子符号表示)。
(3)E和F相比,非金属性强的是(用元素符号表示),下列事实能证明这一结论的是(用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为(填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为,pH=10的乙溶液中由水电离产生的c(OH-)=mol·L-1。
下表为部分短周期元素化合价及相应原子半径的数据:
| 元素性质 |
元素编号 |
|||||||
| A |
B |
C |
D |
E |
F |
G |
H |
|
| 原子半径(nm) |
0.102 |
0.110 |
0.117 |
0.074 |
0.075 |
0.071 |
0.099 |
0.077 |
| 最高化合价 |
+6 |
+5 |
+4 |
+5 |
+7 |
+4 |
||
| 最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:
①A与D可形成化合物AD2、AD3;
②E与D可形成多种化合物,其中ED、ED2是常见的化合物,C可用于制光电池。
(1)E在周期表中位置是;
(2)C和H的气态氢化物的稳定性强弱关系为(用分子式表示);
(3)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是。
(4)工业上可用纯碱溶液处理ED和ED2,该反应如下:
ED+ED2+Na2CO3=2+CO2
横线上某盐的化学式应为。
(5)在一密闭容器中发生反应2AD2+D2 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量(填“增加”“减少”或“不变”)其原因为。
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量(填“增加”“减少”或“不变”)其原因为。
(6)请设计一个实验方案,使铜和稀的H2AD4溶液反应,得到蓝色溶液和氢气。绘出该实验方案装置图。
有一种白色粉末,含有下列阴离子和阳离子中的几种。
阴离子:S2-、Cl-、NO、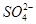 、
、 、
、 、
、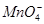 。
。
阳离子:Na+、Mg2+、Al3+、Ba2+、Fe2+、Fe3+、Cu2+、 。
。
将该白色粉末进行下列实验,观察到的现象如下:
| 实验操作 |
现象 |
| a.取少量粉末,加水、振荡 |
全部溶解、 |
| 溶液无色透明 |
|
| b.向所得溶液中慢慢滴入苛性钠溶液,并加热 |
无明显现象 |
| c.取少量粉末,加盐酸 |
无明显现象 |
| d.取少量粉末,加稀H2SO4和稀HNO3的混合液 |
有白色沉淀生成 |
根据实验推断:
(1)从a实验中,可推断粉末中不可能有(填离子符号,下同)。
(2)从b实验中,可推断粉末中不可能有。
(3)从c实验中,可推断粉末中不可能有。
(4)从d实验中,可推断粉末中不可能有,一定含有。
(5)以上各实验仍无法确定是否存在的离子是。
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、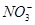 、
、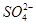 、Cl-、I-、
、Cl-、I-、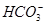 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
| 实验步骤 |
实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 |
溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 |
有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 |
有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 |
有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
(1)溶液中一定存在的离子是;溶液中肯定不存在的离子是。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)。
(3)写出实验⑤中所有反应的离子方程式:。
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、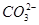 、
、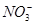 、
、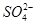 ,已知:
,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是;所含阴离子相同的两种盐的化学式是。
(2)D的化学式为,D溶液显碱性的原因是(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是;
E和氨水反应的离子方程式是。
(4)若要检验B中所含的阳离子,正确的实验方法是。