下列反应的离子方程式书写正确的是
| A.用氨水吸收过量SO2气体:2NH3·H2O+SO2=2NH4++SO32-+H2O |
| B.FeI2溶液中通入C12至Fe2+恰好完全被氧化:2Fe2++C12=2Fe3++2C1- |
C.NH4HCO3溶液与过量的NaOH溶液共热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.将1 mol·L-1 NaAlO2溶液和1.5 mol·L-1的HCl溶液等体积互相均匀混合:6AlO2- + 9H+ + 3H2O = 5Al(OH)3↓+ Al3+ |
下列实验操作中不正确的是
| A.用容量瓶配制一定物质的量浓度的NaOH溶液时,溶解后的溶液要马上转移至容量瓶 |
| B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C.蒸发结晶时当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
下列对于某些离子的检验说法中正确的是
| A.加入硝酸银产生白色沉淀,一定有Ag+ |
| B.某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红气体,说明原溶液中存在NH4+ |
| C.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ |
| D.可用焰色反应实验检验溶液中是否含有K+ |
鉴别NaOH、Na2CO3、Ba(OH)2三种溶液,最好选用下列试剂中的
| A.石蕊溶液 | B.稀盐酸 | C.稀硫酸 | D.CaCl2溶液 |
 I是常规核裂变产物之一,可以通过测定大气或水中
I是常规核裂变产物之一,可以通过测定大气或水中 I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
I的含量变化来检测核电站是否发生放射性物质泄漏。下列有关 I的叙述中错误的是
I的叙述中错误的是
A. I的化学性质与 I的化学性质与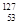 I相同 I相同 |
B. I的原子序数为53 I的原子序数为53 |
C. I的原子核外电子数为78 I的原子核外电子数为78 |
D. I的原子核内中子数多于质子数 I的原子核内中子数多于质子数 |
设NA代表阿伏加德罗常数,下列说法正确的是
| A.23g金属钠变为钠离子时得到的电子数为NA |
| B.标准状况下,18g水所含的电子数目为18NA |
| C.标准状况下,22.4 L氦气所含的原子数目为2NA |
| D.常温常压下,2.8g N2和CO的混合气体所含原子数为0.2NA |