某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)

(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯给装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
已知:3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色)
①乙组得到的黑色粉末是 ;
②甲组步骤1中反应的离子方程式为 ;
③乙组步骤4中,溶液变红的原因为 ,溶液褪色可能的原因及其验证方法为 ;
④从实验安全考虑,上图装置还可采取的改进措施是 ;
现用物质的量浓度为amol·L-1的标准NaOH溶液去滴定VmL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________________________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入(选填“甲”或“乙”)中。
(3)右图是碱式滴定管中液面在滴定前后的读数,c(HCl)=_______________mol·L-1。
(4)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则滴定的HCl物质的量浓度会偏____________(填“大”或“小”)。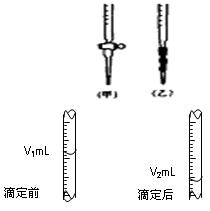
(5)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度(mol·L-1) |
滴定完成时, NaOH溶液滴入的体积(mL) |
待测盐酸的体积(mL) |
| 1 |
0.10 |
22.62 |
20.00 |
| 2 |
0.10 |
22.72 |
20.00 |
| 3 |
0.10 |
22.80 |
20.00 |
①滴定达到终点的标志是______________________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为(保留两位有效数字)。
某校化学小组学生利用下图装置进行“氨的催化氧化及其产物验证”实验。
(图中夹持装置已略去)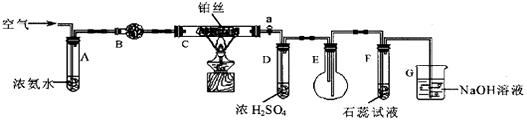
(1)装置B中盛放的试剂是__________(填名称),用来吸收混合气体中的水汽。
(2)反应开始时,将装置C中铂丝加热到红热,撤去酒精灯,铂丝变暗。此时鼓入空气,铂丝又变红热。写出C中反应的化学方程式_______________________________________。
(3)实验过程中,装置D中的导管容易生成无色晶体而堵塞。为了解决该问题,可以在活塞a后增加______(选填序号)。
①盛有蒸馏水的洗气瓶 ②盛有浓盐酸的洗气瓶 ③盛有碱石灰的U形管
(4)装置E中的含氮化合物有NH3、NO、NO2、________________(填化学式)。
(5)F中紫色石蕊试液变红,G装置的作用 ___________________________。
(6)工业上合成氨的反应是:N2(g)+3H2(g) 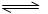 2NH3(g);△H=-92.2kJ·mol-1。
2NH3(g);△H=-92.2kJ·mol-1。
①下列做法能够提高工业合成氨转化率的是_________(选填字母)
a.增大压强 b.升高温度 c.使用铁触媒d.将生成的NH3及时从混合气体中分离出去
②工业合成氨时采用500℃左右的温度,主要是因为________________。
(12分)实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: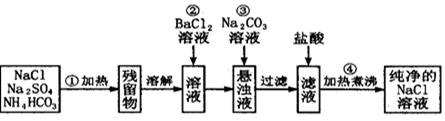
如果此方案正确,那么:
(1)操作①可选择_____仪器。
| A.烧瓶 | B.烧杯 | C.锥形瓶 | D.坩埚 E、蒸发皿 |
(2)操作②是否可改为加硝酸钡溶液?为什么?(填能或不能)理由
(3)进行操作②后,如何判断SO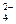 已除尽,方法是__________
已除尽,方法是__________
(4)操作③的目的是_________
为什么不先过滤后加碳酸钠溶液?理由是___________________。
(5)操作④的目的是____________________。
Ⅰ⑴用14.2g无水硫酸钠配制成500 ml溶液,其物质的量浓度为▲mol/L。
⑵若从上述溶液中取出10 ml,则这10 ml 溶液的物质的量浓度为▲mol/L,含溶质的质量为▲g。
⑶若将上述10 ml 溶液用水稀释到100 ml,所得溶液中Na+的物质的量浓度为▲mol/L;若将稀释后溶液中的SO42-全部沉淀下来,至少需要加入0.1 mol/L的BaCL2溶液
▲ml 。
Ⅱ现有36%的醋酸(CH3COOH),密度为1.04g/ml.,
欲配制0.1 mol/L的醋酸250 ml,需要取用36%的醋酸▲ml。
需要使用的实验仪器有烧杯、▲、▲、▲、▲,
若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度 ▲(填“正确”、“偏大”或“偏小”)。
▲(填“正确”、“偏大”或“偏小”)。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,为了检验SO2和C2H4的性质,有人设计下列实验方案。
(1)I、II、III、IV装置可盛放的试剂是I▲;II▲;III▲;IV▲(将下列有关试剂的序号填入空格内);
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是▲;
(3)使用装置II的目的是▲;
(4)确定含有乙烯的现象是▲。
(5)如果Ⅳ盛放的溶液为溴水,那么发生的化学方程式为▲,反应类型为▲