(10分)掌握仪器的名称,组装及使用方法是中学化学实验的基础,如图为两套实验装置。

(1)写出下列仪器的名称:
① ② ④ ;
(2)仪器①~④中,使用时必须检查是否漏水的是:(填序号) 。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;该实验操作过程中需要通入冷却水,通入的方向是 (g或f)口进水, (g或f)口出水。
(4)现需配制250 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是 。

已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2), 某小组同学设计了如图所示装置(夹持仪器和连接用的乳胶管已经省略)。
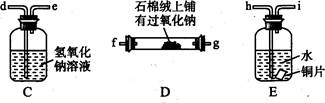
(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为a→( )( ) →( )( ) →( )( ) →( )( )(填仪器接口的字母编号)。连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通人氮气的主要目的是。
(2)简述使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作:。装置E中观察到的主要实验现象有。
(3)装置C的作用是。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:。
溴化钙具有易溶于水,易吸潮等性质。溴化钙可用作阻燃剂、制冷剂,实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸500ml,所需的玻璃仪器有玻璃棒、。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是,控制溶液的pH约为8.0的目的是、。
(3)试剂b是氢溴酸,步骤Ⅳ的目的是。
(4)步骤Ⅴ所含的操作依次是,过滤。
(5)制得的溴化钙可以通过如下步骤测定其纯度:
①称取 4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应;④;⑤;⑥;⑦称量。若得到1.56g碳酸钙,则溴化钙的质量分数为(保留两位小数)。若实验操作规范而测定结果偏低,其原因是。
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因:、。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明;
实验III的目的是。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制mol•L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH约为3。由此,乙认为红色不褪去的可能原因是。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 |
试剂及操作 |
现象 |
| i |
生成白色沉淀 |
|
| ii |
向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
下列装置用于二氧化锰和浓盐酸在加热条件下反应制取纯净、干燥的氯气。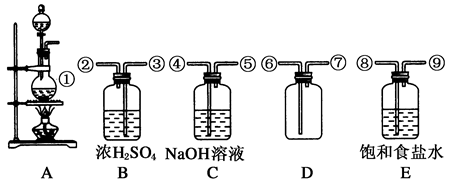
(1)在装置A~E中,有①~⑨ 9个接口,用编号表示仪器的导气管连接顺序依次为________、________、________、________、________、________、________、________、________。
(2)B瓶中浓H2SO4的作用是________________,E瓶盛有的饱和食盐水的作用是
________________________________________________,C瓶中盛有NaOH溶液的作用是__________________,此装置收集氯气的方法为。
(3)写出此实验装置制氯气的化学方程式,
工业用氯气制漂白粉的化学方程式是____________________________。
Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1)S2O32-能被I2氧化为S4O62-; (2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ、市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
| 实验步骤 |
预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
固体完全溶解得无色澄清溶液 |
| 步骤2: |
|
| 步骤3: |
Ⅱ、利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0gNa2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL 0.01mol·L-1 K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+ I2=== S4O62-+ 2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1) 步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、和 。
(2) 完成并配平步骤②中的离子反应:Cr2O72- + ( ) + I-=I2+ Cr3++ H2O。
(3) 步骤③中,指示剂最好选用,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是。
(4) 若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为。