汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成。某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质。
I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
写出一氧化碳与一氧化氮反应的化学方程式:
II.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:
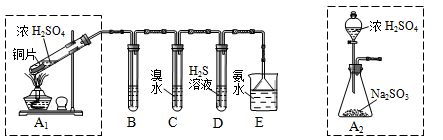
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ;C中反应的离子方程式为 。
(2)为了实现绿色环保的目标,制取SO2装置最好选择 。(A1或A2装置)
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为 。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。 现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 |
预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 步骤3: |
|
(一)下图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去)。请根据要求完成下列各题。
(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应。所选装置的顺序依次为(从左向右)
(2)A中发生反应的化学方程式为;
(3)实验过程中,先点燃(写字母编号)处的酒精灯,观察到什么现象_______再点燃(写字母编号)处的酒精灯。E管中的反应现象
(二)化学反应的产物往往跟反应条件密切相关,下图中:
①为氯气发生装置;
②的试管里盛有15 mL 4mol/L NaOH溶液,并置于水浴中;
③的试管里盛有15 mL 0.5mol/LNaOH溶液,并置于冰水浴中;
④为尾气吸收装置。
实验结果表明②中有氯酸钠生成③中有次氯酸钠生成。
(4)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①;
②。
(5)反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是(填写编号字母);从②的试管中分离出该晶体的方法是(填写实验操作名称)。
(三)(6)若实验中大约需要225mL0.5mol/L的NaOH溶液,至少需要称量NaOH固体___________g,现有可供选择的仪器:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥500mL容量瓶 ⑦托盘天平 。配制上述溶液还需提供的仪器有____________________
Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。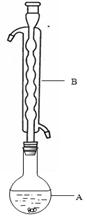
④滤液在经过、后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________。其作用是____________________。
加入的硫粉用乙醇润湿的目的是。
(2)步骤④应采取的操作是、。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是。
如果滤液中该杂质的含量不很低,其检测的方法是:。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+ I2= S4O62-+ 2I-),滴定结果如下:
| 滴定次数 |
滴定前读数(mL) |
滴定滴定后读数(mL) |
| 第一次 |
0.30 |
31.12 |
| 第二次 |
0.36 |
31.56 |
| 第三次 |
1.10 |
31.88 |
则所得产品的纯度为,你认为影响纯度的主要原因是(不考虑操作引起误差)。
(15分)氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气。
Ⅰ.工业上通常采用电解法制氯气:观察下图,
回答:
(1)若饱和食盐水中含有酚酞,通电后_______(填a或b)侧先变红。
(2)电解反应的化学方程式为________。
(3)生产的氯气常用于制备漂白粉,请写出漂白粉长期露置在空气中失效,且属于氧化还原反应的一条化学方程式。
Ⅱ.下图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去)。请根据要求完成下列各题。
(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应。所选装置的顺序依次为(从左向右);
(2)写出A中反应的化学方程式并用双线桥法表示反应中电子转移的方向和数目____________;若在标准状态下收集到2.24 L氯气,则被氧化的HCl的物质的量是____________mol。
(3)E管中现象______________________________。脱脂棉的作用是_________________________。
实验室用一定比例的乙醇、乙酸和浓硫酸的混合液制备乙酸乙酯,装置如图所示:
(1)写出生成乙酸乙酯的化学方程式:
(2)B试管中加入饱和碳酸钠的作用是:
(3)其中导管要插在液面上而不能插入溶液中,目的是
(4)实验完成后,试管B的液面上有透明的不溶于水的油状液体产生。若分离10mL该液体混合物需要用到的主要玻璃仪器是,这种方法叫做。
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和 A中加热装置已略)。
实验过程:
①检查装置气密性后,在各仪器中添加相应试剂。
②打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
③打开活塞a,滴加一定量的浓盐酸,加热A。
④当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
⑤打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
⑥打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
⑦更换试管D,重复过程⑤,检验B溶液中的离子。

试回答下列问题:
(1)检验图中虚线框内装置气密性的具体操作是。
(2)C中发生反应的化学方程式为。
(3)B中的棉花通常会浸润试剂;实验②中通入N2的作用是。
(4)甲、乙、丙三位同学分别完成了上述实验,
他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是(填“甲”、“乙”或“丙”)。
| 过程⑤ B溶液中含有的离子 |
过程⑦ B溶液中含有的离子 |
|
| 甲 |
有Fe3+无Fe2+ |
有SO42- |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有Fe2+ |
(5)进行实验过程⑥时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe2+(aq)+SO32-(aq) FeSO3(s)(墨绿色)
FeSO3(s)(墨绿色)
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立: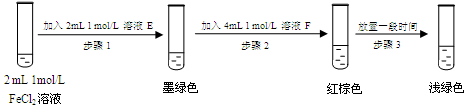
① 溶液E和F分别为、。
② 请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因。