(6分)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: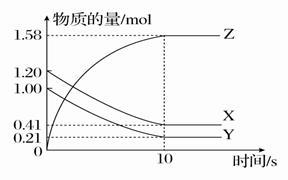
(1)从反应开始到10 s,用Z表示的反应速率为________。X的物质的量浓度减少了___________,Y的转化率为________。
(2)该反应的化学方程式为_____________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示: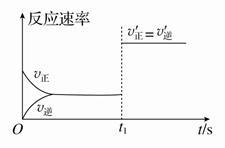
则下列说法符合该图像的是________。
| A.t1时刻,增大了X的浓度 | B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 | D.t1时刻,使用了催化剂 |
[化学选修——2.化学与技术](15分)碳酸钠是一种重要的化学基本工业产品。比利时人索尔维发明了氨碱法生产碳酸钠,氨碱法生产原理示意图如下:
我国化工专家设计了联合制碱法,联合制碱法生产原理示意图如下: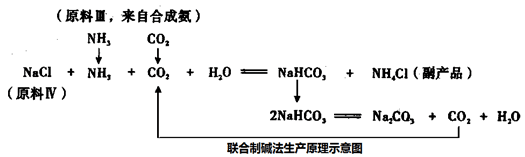
请回答下列问题:
(1)从索尔维制碱法生产原理示意图可知,氨碱法的总反应方程式为 ______________。按照绿色化学原则,理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,实现废弃物的零排放。计算索尔维制碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)______________。
(2)试列举出索尔维制碱法的两大缺点。
①______________;②_____________。
(3)设计联合制碱法的我国化工专家是______________;
(4)从联合制碱法生产原理示意图可知,原料III 中的CO2来自合成氨,指出步骤名称,并写产生CO2化学方程式。
步骤I:__________,化学方程式_________________,
步骤II:__________,化学方程式__________。
(14分)亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
【化学——选修5:有机化学基础】有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3,它们的核磁共振氢谱中均出现4个峰。
请回答:
(1)B中所含官能团的名称为 ;D的分子式为 ;
(2)Ⅲ的反应类型为 (填字母序号);
a.还原反应b.加成反应c.氧化反应d.消去反应
(3)写出下列反应的化学方程式:
Ⅰ: ;
Ⅱ: ;
(4)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为 ;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个—CH3,它们的结构简式为 和 ;
(6)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 。
【化学——选修3:物质结构与性质】A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。回答下列问题:
(1)D原子的核外电子排布式为 ,E的价层电子轨道示图为______________。
(2)单质B有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;
(3)A、B、C中第一电离能最大的是________(填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是 。
(4)化合物D2B的立体构型为 ,单质D与湿润的Na2CO3反应可制备D2B,其化学方程式为 .
(5)E与C所形成化合物晶体的晶胞如图所示。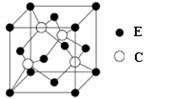
①在1个晶胞中,E离子的数目为 。
②该化合物的化学式为 。
【化学——选修2:化学与技术】丙酮和苯酚都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm﹣3) |
沸点/℃ |
| 苯酚 |
94 |
1.0722 |
182 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 异丙苯 |
120 |
0.8640 |
153 |
回答下列问题:
(1)反应①和②分别在装置 和 中进行(填装置符号).
(2)反应②为 (填“放热”或“吸热”)反应.反应温度控制在50﹣60℃,温度过高的安全隐患是 .
(3)在反应器A中通入的X是 .
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是 ,优点是用量少,缺点是 .
(5)中和釜D中加入的Z最适宜的是 (填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3d.CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 .
(7)用该方法合成苯酚和丙酮的优点是 .