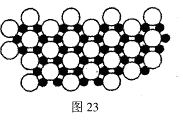
下图A一G是几种烃的分子球棍模型:
请回答下列问题:
(l)含氢量最高且常温下为气态的烃是(填对应字母) ;
(2)一卤代物种类最多的是(填对应字母) ;
(3)A一G在充有足量氧气的密闭恒容容器中完全燃烧,150℃时测得燃烧前后的压强不变的有 (填对应字母);
(4)写出实验室制取D的化学方程式 。
目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:
①写出反应①的离子方程式。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是。
(4)FeO42—在水溶液中的存在形态图如图所示。
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,转化为(填化学式)。
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol-1
②2CO(g)+ O2(g)= 2CO2(g)△H= _556.0 kJ·mol-1
③H2O(l) = H2O(g) △H="+" 44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式。
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。则电源中a极为极(填“正”或“负”),其电极反应式为。装置上端A极电极材料是(填化学式),B电极上的电极反应式为。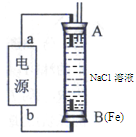
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g) +H2O(g)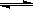 CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为(填“吸”或“放”)热反应。
②实验1中,以v(H2)表示的平均反应速率为。
③900℃时,按CO(g)、H2O(g)、CO2(g) 和H2(g)的物质的量分别是0.8mol、1.0mol、0.6 mol和0.8 mol分别加入该容器,则此时反应的v(正)v(逆)(填“>”“<”或“=”中之一)。
④实验3跟实验2相比,改变的条件可能是。
苄佐卡因是一中医用麻醉药品,学名对氨基苯甲酸乙酯,它以对硝基甲苯为主要起始原料经下列反应制得:
请回答下列问题:
(1)写出B的结构简式:B。
(2)用1H核磁共振谱可以证明化合物C中有种氢原子处于不同的化学环境。
注:E、F、G结构如下: 、
、 、
、
(3)E、F、G中有一化合物经酸性水解,其中的一种产物能与FeCl3溶液发生显色反应,写出该水解反应的化学方程式。
(4)苄佐卡因(D)的水解反应如下:
化合物H经聚合反应可制成高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该聚合反应的化学方程式。
麻醉剂的发现和使用,是人类历史上了不起的一项成就,它可使患者在接受治疗时感觉不到疼痛.
(1)“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一.有关理论认为N2O与CO2具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示为________,其空间构型是________型,由此可见它是________分子(填“极性”或“非极性”)
(2)另一种常用麻醉剂氯仿,常因保存不慎而被氧化,产生剧毒物光气(COCl2)∶2CHCl3+O2→2HCl+2COCl2,为防止中毒事故,使用前可用于检验氯仿是否变质的试剂是________.
| A.酚酞试液 | B.淀粉碘化钾溶液 | C.NaOH溶液 | D.硝酸银稀溶液 |
(3)作为麻醉剂,氙气在医学上备受重视.氙能溶于细胞质的油脂里,引起细胞的麻醉和膨胀,从而使神经末梢作用暂时停止.人们曾试用体积分数为80%氙气和20%氧气组成的混合气体,作为无副作用的麻醉剂.稀有气体氙的化学性质不活泼,但它在一定条件下可与其它物质反应生成化合物.现取1mol氙气和3.5mol氟气于密闭容器中,在一定条件下使反应完毕,剩余有1.5mol氟气,同时有白色固体生成,此白色固体的化学式为________.
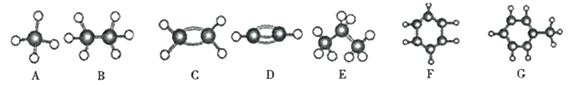
硼元素B在化学中有很重要的地位。硼的化合物在农业、医院、玻璃等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子分布式,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是。
(3)在BF3分子中中心原子的杂化轨道类型是,SiF4微粒的空间构型是。
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图23是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为。