(10分)已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
【有效成分】 NaClO
【规格】 1000 mL
【质量分数】 25%
【密度】 1.19 g·cm-3
(1)该“84消毒液”的物质的量浓度约为________mol·L-1(小数点后保留一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是______(填序号)。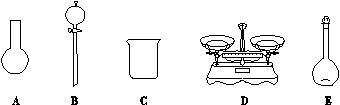
| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 |
| D.需要称量NaClO固体的质量为143.0 g |
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中, H+的物质的量浓度为________mol·L-1。
②需用浓硫酸的体积为________mL。
(6分)新制的氯水含有的分子和离子,现分别做如下实验:
将紫色石蕊试液滴入,溶液显红色,起作用的粒子是______________。
上述溶液逐渐褪去,起作用的粒子是__________________________。
加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的粒子是_____。
某课外活动小组研究金属钾的性质。他们通过Na、K原子结构示意图及查找有关资料,知道了Na、K属于同一类物质,且K燃烧生成KO2。请完成下列内容:
(1)观察钾的切面。硬度: ,颜色:
(2)预测钾的性质,并进行实验验证(用化学方程式表示):
①在空气中缓慢氧化: ;
②点燃,发生剧烈燃烧: ;
③与水剧烈反应: 。
(3)结论:钾是一种活泼的金属单质,其化学性质比钠活泼。
(4)该小组研究钾的性质用到了哪几种方法。
答: 。
某溶液含 Mg2+、Al3+,向其中滴加a mLC1mol·L—1NaOH之后,改成滴加C2mol·L—1H2SO4溶液,所得沉淀Y(mol)与所加试剂总体积V(mL)间的关系如下图所示。据此,回答下列问题: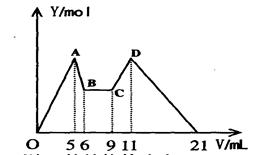
(1)C-D过程中的离子方程式__________________________________________;
(2)n(Mg2+)/ n(Al3+) =______________;
(3)C1/C2=______________;
(4)所加入NaOH溶液的体积a=______________mL。
科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点: ①H-O-O-H、②  。式中O→O表示配位键,即共用电子对由某原子单方面提供(已知在化学反应中氧氧键遇到还原剂时易断裂)。
。式中O→O表示配位键,即共用电子对由某原子单方面提供(已知在化学反应中氧氧键遇到还原剂时易断裂)。
化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应,生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
(1)用电子式表示①、②两种结构:①_________________、②________________。
(2)如果H2O2的结构如①所示,实验c中化学反应方程式为(A写结构简式,下同)___________________________________________________________________;假如H2O2的结构如②所示,实验c中化学反应方程式为____________________________。
(3)为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:______________________________________________。
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验: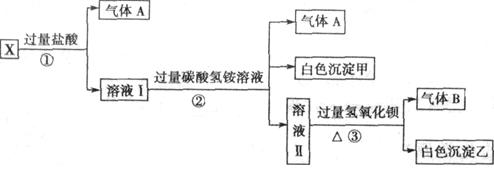
(1)白色沉淀甲是 _________。
(2)X溶液中一定存在的离子是_____________。
(3)白色沉淀乙中一定有:______,可能有_______ 证明其是否存在的方法是______________。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式_____________。