氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。某化学小组的同学在老师的指导下制备氢化钙。
【查阅资料】
氢化钙通常用氢气与钙加热制得。
氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
钙遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热。
标准状况下氢气的密度为0.09g/L。
【进行实验】小组同学设计的制取装置如下图所示(固定装置略)。

回答下列问题:
(1)写出A中发生反应的化学方程式 。
(2)B、D中所盛试剂相同,该试剂为 ,其作用分别是 、 。
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是 。
(4)装置C中制取氢化钙的化学方程式是 。
【实验反思】小组同学通过反思提出问题:上述制得的氢化钙是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量的氢化钙样品,按图所示连接仪器(固定装置略).

步骤2:将Y形管倾斜,使A中的水全部进入B中,完全反应后,冷却至室温,读取量筒读数.
通过上述实验可分析出制得的氢化钙是否纯净,其依据是______.
某化学兴趣小组利用图一装置制取氨气并探究氨气的有关性质。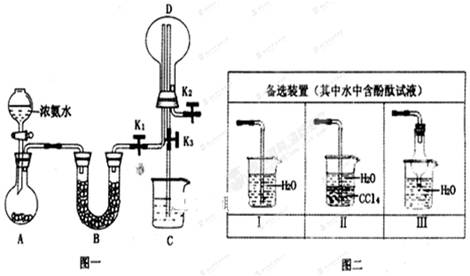
(1)装置A中烧瓶内试剂可选用________(填序号)
a.碱石灰
b.浓硫酸
c.生石灰
d.五氧化二磷
e.烧碱
(2)若要探究氨气溶于水后所得溶液的酸碱性,需在K2的导管末端连接图二装置中的装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是_______。
(3)若要探究氨气的还原性,需打开K1、K2,K3处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成气体必须依次通过盛有_____、试剂的洗气瓶后收集。
②D中氨气与氯气反应产生白烟,同时生成一种无色无味无毒的气体,该反应的化学方程式为____。
③从K3导管处逸出的气体中含有少量Cl2,则C中应该盛放溶液,反应的离子方程式为。
类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是Fe(NO3) 2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12足量时生成 FeC13 , 当铁粉过量时产物是FeCl2 。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的C12中点燃,取其表面生成物并分别编号为A、B,然后通过实验确定其成分。
探究过程如下:
提出假设:A是FeCl3,B是FeCl2 。
(1)设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
| 实验方法 |
实验现象 |
结论 |
| 分别向A、B溶液中加KSCN溶液 |
____________________ |
固体物质中有FeCl3 |
| 分别向KMnO4溶液中加适量A、B溶液 |
KMnO4溶液颜色无明显变化 |
固体物质中不含_______ |
(2)根据上述实验结论,写出C12与铁粉加热时发生反应的化学方程式____________________。
(3)为进一步探究 FeC13溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是____
(填写序号)。
A.将 A 溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到FeC13固体
(4)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。
该方案中涉及的四种阳离子的氧化性由强到弱的顺序为。
方案2:在废液中加入适量的盐酸调节溶液的 pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。该方案中铜作_________极,该电极上所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)____________________。
方案2在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为____。
(1)下列实验操作中,错误的是_____________(填序号,下同)
①用10mL量筒量取6.4 mL盐酸;
②切割金属钠时,将残留物放入废物缸中;
③配制FeSO4溶液时一般要加入适量铁屑;
④配制一定物质的量浓度的溶液定容时仰视读数会使所配溶液浓度偏高;
⑤不慎接触过多的氨,应及时吸入新鲜的空气和水蒸气,并用大量水冲洗眼睛;
⑥用带橡皮塞的棕色试剂瓶存放浓HNO3;
⑦稀释浓硫酸时应把水倒入浓硫酸中。
(2)下图为实验室制H2的装置。若液面刚好不与锌粒接触而又无酸液可加入,则可以从长颈漏斗中加入适量试剂是__________________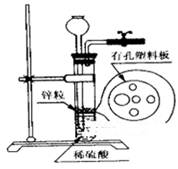
①食盐水②苯③四氯化碳
④Na2CO3溶液⑤硫酸铜溶液⑥KNO3溶液
(选考)【化学——选修2:化学与技术】
实验室里用某工厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备绿矾(FeSO4·7H2O)和聚铁(碱式硫酸铁的聚合物),其过程如下: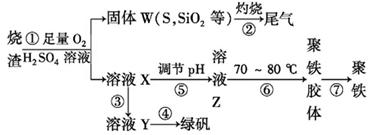
(1)若用浓硫酸配制过程①所需的250 mL 3.0 mol·L-1的稀硫酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要。
(2)过程②用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有(填仪器名称),该过程产生的尾气会对大气造成污染,可选用下列试剂中的吸收。
a.浓硫酸 b.蒸馏水c.NaOH溶液d.浓硝酸
(3)过程③中,需要加入的物质名称是,检验溶液X中金属阳离子是否完全转化的试剂为(填试剂名称)。
(4)过程④的操作是将溶液、、过滤、洗涤,即得到FeSO4·7H2O晶体。过程⑥中,将溶液Z加热到70~80℃,目的是___________________。
(5)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品3.200 g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为。
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示: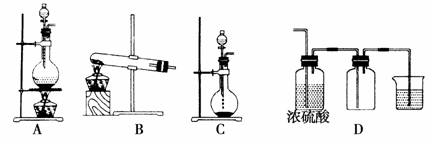
(1)实验室可以用B或C装置制取氨气,如果用B装置制取氨气其化学反应方程式为_________________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是_______________(填序号,下同)。
①密度②颜色③溶解性 ④热稳定性⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2②NO ③Cl2④H2⑤HCl
其中在D装置中连接小烧杯的目的是____________________。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
氨的测定装置(已省略加热和夹持装置)
①装置中安全管的作用原理是__________________________________________。
②样品中氨的质量分数表达式为________。