饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质。A、B、C、D、E五种常见化合物都是由下表中的离子形成:
| 阳离子 |
K+ Na+ Cu2+ Al3+ |
| 阴离子 |
SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B: ;D: 。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为__________。
(3)写出实验②发生反应的离子方程式: 、 。
(4)C常用作净水剂,用离子方程式表示其净水原理: 。
下图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体, E为淡黄色的固体。它们之间有如下转化关系: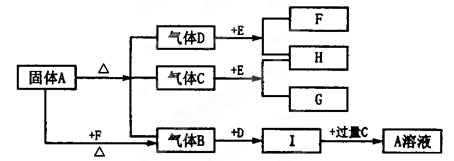
(1)写出A的化学式;C的结构式;
(2)A溶液与过量F溶液反应的离子方程式
根据要求完成下列各小题
(1)①实验室用加热固体混合物的方法制备氨气的化学反应方程式是。
②为了得到干燥的NH3,用________做干燥剂。(填编号)
| A.碱石灰 | B.浓H2SO4 | C.无水CaCl2 | D.P2O5 |
(2)H2O参与的置换反应:
符合X+W→Y+V,已知X和Y分别是短周期同主族两种元素形成的单质, W、V是化合物
①W是水且V的焰色反应为黄色,离子方程式 ;
②V是水,化学方程式为 。
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。
(1)基态Ni2+的核外电子排布式为。
(2)丁二酮肟组成元素中C、N、O的电负性由大到小的顺序为。丁二酮肟分子中C原子轨道的杂化类型是。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式。
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g)△H 1=-90.7 kJ·mol-1
CH3OH(g)△H 1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g)△H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)△H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g)△H 3=-41.2kJ·mol-1
CO2(g)+H2(g)△H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是。
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是。
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为。
图1图2图3
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是。
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
|
| 溶解度/g |
111 |
33.7 |
11.1 |
6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是;不宜用盐酸的原因是。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为。
②达到滴定终点的标志为。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度。(填“偏高”、“偏低”或“无影响”)
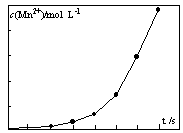
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为。