关于下图所示装置(盐桥含KCl)的叙述,正确的是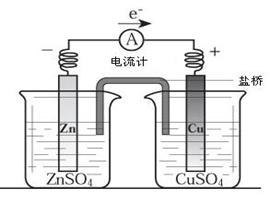
| A.铜离子在铜片表面被氧化 |
| B.铜作阳极,铜片上有气泡产生 |
| C.电流从锌片经导线流向铜片 |
| D.右侧烧杯中,SO42-的物质的量几乎不变,K+的数目增多 |
已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。现以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
| A.燃料电池的总反应为:2Al+3HO2- = 2AlO2-+ 2H2O |
| B.电解时,Al消耗2.7g,则产生氮气的体积为1.12L |
| C.电极b是负极,且反应后该电极区pH增大 |
| D.电解过程中,电子的流向由a→d,c→b。 |
25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
| 序号 |
① |
② |
③ |
④ |
| 溶液 |
NaCl |
CH3COONH4 |
NaF |
NaHCO3 |
| pH |
7.0 |
7.0 |
8.1 |
8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)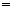 0.1 mol/L
0.1 mol/L
一定温度下,在一个容积为1 L的密闭容器中,充入1 mol H2(g)和1 mol I2(g),发生反应H2(g)+I2(g) 2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,在该温度下,在另一个容积为2L的密闭容器中充入1 mol HI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)占气体体积的50%,在该温度下,在另一个容积为2L的密闭容器中充入1 mol HI(g)发生反应HI(g)
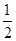 H2(g)+
H2(g)+ 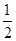 I2(g),则下列判断正确的是
I2(g),则下列判断正确的是
| A.后一反应的平衡常数为1 |
| B.后一反应的平衡常数为0.5 |
| C.后一反应达到平衡时,H2的平衡浓度为0.25 mol·L-1 |
| D.后一反应达到平衡时,HI(g)的平衡浓度为0.5 mol·L-1 |
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O 2H++ 2CrO42-(黄色)
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72-+ 14H++ 6Fe2+ 2Cr3+(绿色) + 6Fe3++ 7H2O。下列分析正确的是
2Cr3+(绿色) + 6Fe3++ 7H2O。下列分析正确的是
| A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡 |
| B.实验②能说明氧化性:Cr2O72- > Fe3+ |
| C.CrO42- 和Fe2+在酸性溶液中可以大量共存 |
| D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是
A.反应②中的能量变化如图所示,则ΔH2=E1-E3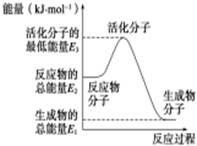 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1 |