某废水中可能含有下列离子中的若干种:
Fe3+、Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。现进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液,无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入过量浓氨水,仅有红褐色沉淀生成。过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成。
请回答下列问题:
(1)该废水一定含有的离子是________。
(2)实验Ⅱ中加入少量盐酸生成无色气体的离子方程式是___________。
(3)过滤除去Ⅳ中的蓝色沉淀,调整滤液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1: 4,其离子方程式为Al+NO3-+OH-―→AlO2-+NH3+N2+H2O(未配平)。还原产物是________。若除去0.2 mol NO3-,要消耗铝________g。
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。下列处理措施和方法中正确的是________。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
碱性的废水 |
用CO2中和 |
化学法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含复杂有机物的废水 |
通过微生物代谢 |
物理法 |
| D |
废酸 |
加生石灰中和 |
化学法 |
从H+、Cu2+、Na+、SO42-、Cl-等五种离子中选择适当的离子组成电解质,使之符合下列要求。
(1)以碳棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是________________
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是_______________;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是_____________________________。
铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
(1)蓄电池的负极是______,其电极反应式为______。
(2)蓄电池的正极是______,其电极反应式为______。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。 (4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是
(4)实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是
家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式____________________,已知1mol液态水气化时需要吸收44kJ的热量,则反应 的ΔH为____________________。
的ΔH为____________________。
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3- Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-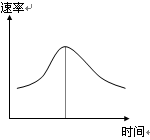
(1)反应开始时反应速率加快的原因是;
(2)反应后期反应速率下降的原因是。

如图所示,已知G 、A分别是海水中含量最多的两种化合物,E是“84”消毒液的主要成分具有漂白性,请回答以下问题:
(1)分别写出A、C、D、F、E的电子式:A、C、
D、F、E ;
(2)电解G 、A的混合物阴极上的电 极反应式为
极反应式为
若同时在两电极附近各滴入几滴酚酞试液,阴极附近观察到的现象是;
阳极上的电极反应式为,检验该电极反应产物的方法是。
(3)C和D反应可以生成一种强酸盐和生成一种弱酸盐写出方程式该弱酸盐具有
性,常用于杀菌消毒。