热化学方程式中的H实际上是热力学中的一个物理量,叫做焓。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)对于化学反应A+B=C+D,若 ,则该反应的ΔH为 0(填“大于”.“小于”),该反应是 (填“放热”或“吸热”)反应;
,则该反应的ΔH为 0(填“大于”.“小于”),该反应是 (填“放热”或“吸热”)反应;
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=" -185" kJ·mol-1 ΔH298(H2)=" 436" kJ·mol-1 ,
ΔH298(Cl2)=" 247" kJ·mol-1。 则ΔH298(HCl)= ____________。
(3)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH =" -25" kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH =" -" 47 kJ·mol-1
Fe3O4(s) +CO(g)=3FeO(s)+CO2(g) ΔH =" 19" kJ·mol-1
请写出CO还原FeO的热化学方程式: 。
根据下列几种粒子的结构示意图,回答问题:(填元素符号或离子符号)
(1)其中属于阴离子的是,
(2)属于金属元素的是,
(3)具有相似化学性质的是.
人们认识原子结构经历了古典原子论、近代原子论、模型、模型和现代原子论等几个阶段。
有FeCl3和AlCl3的混合溶液100ml,向其中加入过量的NaOH溶液,充分反应后,过滤,干燥,共生成沉淀10.7g。
(1)写出混合溶液中加入过量NaOH溶液的离子方程式、;
(2)将10.7g沉淀加热灼烧,最后得到固体克;
(3)FeCl3的物质的量的浓度是mol/L;
(4)在加入NaOH溶液的过程中,生成沉淀的质量与加入NaOH溶液的体积如下图所示,计算AlCl3的物质的量的浓度mol/L;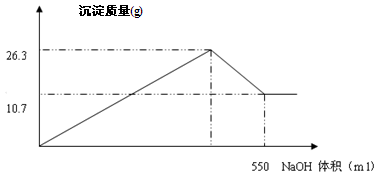
(5)求NaOH溶液的物质的量浓度?(提示:请写出第(5)小题的解题过程)
在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)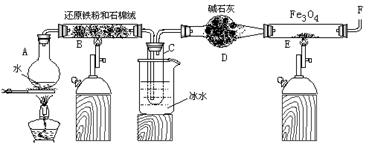
(1)烧瓶A中常加入碎瓷片,其作用是,B中石棉绒的作用,小试管C的作用是。
(2)反应开始时先点燃处(填A或B)酒精灯,为了安全,在E管中的反应发生前,在F出口处必须,E管中的反应开始后,在F出口处应。
(3)写出高温下Fe 与H2O(g)反应的化学方程式,在一定条件下该反应实际上是可逆反应,试用化学平衡移动原理加以解释本实验中是如何实现Fe向Fe3O4的转变的。
(4)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象____________________________________________________。
粉末状试样A是由等物质的量的MgO和Fe2O₃组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20克A全部溶于0. 15L 6mol·L -1的盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L气体(标准状况),同时生成溶液D,还有残留固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是,
产物中的单质B是。
(2)②中所发生的各反应的化学方程式是、。
(3)③中所发生的各反应的离子方程式是、。
(4)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为,c(Fe2+)为。