(1)下列物质能导电的是 ,属于电解质的是 ,
属于非电解质的是 。
①NaCl晶体 ②液态SO2 ③液态醋酸 ④汞 ⑤BaSO4固体
⑥纯蔗糖(C12H22O11) ⑦氨水 ⑧熔化的KNO3
(2)按要求写出下列方程式:
①KHSO4熔融状态电离方程式:_________________
②苏打与过量稀盐酸反应的离子方程式:_________________
(3)①36g水中氧原子的物质的量为: _________________。
②在同温同压下,相同体积的O2和CH4,原子数目之比为______________。
③含有6.02×1023个氦原子的氦气在标准状况下的体积约为 。
有一可左右滑动的密封导热隔板,当拔起销钉后,两侧分别开始进行如图所示的可逆反应,隔板随之开始移动。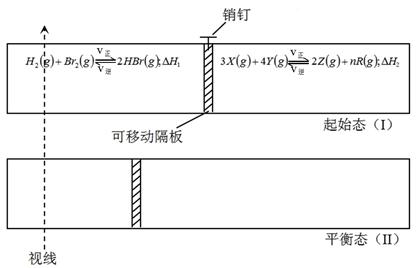
各物质的起始加入量
| 物质 |
H2 |
Br2(g) |
HBr |
X |
Y |
Z |
R |
| 物质的量(mol) |
2.0 |
2.0 |
5.0 |
设x |
8.0 |
0.50 |
1.5 |
当x在一定范围内变化时,均可因为隔板的导热作用而调节反应器左右两侧的温度,使两侧反应都达到平衡。在整个反应过程中隔板始终左滑,一段时间后,隔板恰好处于反应器左端1/3处不动,达平衡后保持温度不变。试回答:
(1)化学方程式中R物质的化学计量数n为(填编号,下同)
A.3 B.4 C.5 D.6
(2)若x=6.5,则右侧反应在起始时向方向(填“正反应”或“逆反应”)进行;欲使起始反应维持向该方向进行,则x的取值范围为。
(3)若已知ΔH 1<0,ΔH 2<0, x分别为6.5和7.0时,在这两种情况下,反应分别达到平衡状态(Ⅱ)时,请比较H2体积分数(分别记作φ(H2)、φ(H2’))的相对大小。
A.φ(H2)>φ(H2’) B.φ(H2)<φ(H2’)
C.φ(H2)=φ(H2’) D.不能确定
(4)若x=6.5时,左右两侧反应体系达平衡后,设法向左侧容器中再充入a mol氢气,当左、右两侧反应体系再次平衡时(隔板平衡点位置不变,下同)a的取值范围是。
(5)若x=6.5时,且左右两侧反应体系均达到平衡后,如向右侧反应体系中充入b mol氦气,片刻后,使容器两侧又均达到平衡。则右侧化学平衡将向方向(填“正反应”或“逆反应”)移动;b的最大值应小于。
A、B、C、D、E、F六种元素均是短周期元素,且原子序数依次增大。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)转化关系如图(反应条件略去),元素E形成的单质是 “21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
(1)写出M与甲的浓溶液加热时反应的化学方程式。
(2)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为;X、Y、W都能与Z反应,则Z的结构式为。
(3)将X、W与D2按1∶1∶n的物质的量之比通入Z中,充分反应后无气体剩余或生成,则n=,写出反应的化学方程式。
(4)化合物ED2与元素B形成的某种单质晶体类型相同,且在高温下能发生置换反应。若反应中B的单质被破坏1 mol共价键,则参加反应的化合物ED2的质量为g。
(5)元素B的另一种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,则12 g该晶体中含有NA个正六边形。
TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:(填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答:。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g) TiCl4(l)+O2 (g)ΔH=+151 kJ·mol-1
TiCl4(l)+O2 (g)ΔH=+151 kJ·mol-1
所以不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) = CO2 (g)ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g)ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
(A)(12分)工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)基态钛原子的核外电子排布式为▲。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于▲晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 ▲。
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ▲,原因是 ▲。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ▲,分子的空间构型为 ▲。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 ▲。
(10分)工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1: ▲。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为 ▲。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为▲;
②若V=35,试计算混合物中CuS的质量分数。