有一可左右滑动的密封导热隔板,当拔起销钉后,两侧分别开始进行如图所示的可逆反应,隔板随之开始移动。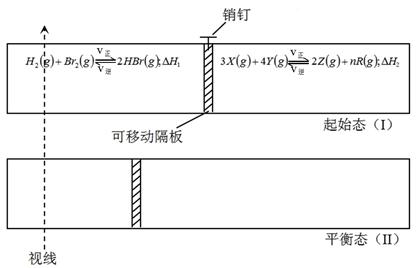
各物质的起始加入量
| 物 质 |
H2 |
Br2(g) |
HBr |
X |
Y |
Z |
R |
| 物质的量(mol) |
2.0 |
2.0 |
5.0 |
设x |
8.0 |
0.50 |
1.5 |
当x在一定范围内变化时,均可因为隔板的导热作用而调节反应器左右两侧的温度,使两侧反应都达到平衡。在整个反应过程中隔板始终左滑,一段时间后,隔板恰好处于反应器左端1/3处不动,达平衡后保持温度不变。试回答:
(1)化学方程式中R物质的化学计量数n为(填编号,下同)
A.3 B.4 C.5 D.6
(2)若x=6.5,则右侧反应在起始时向 方向(填“正反应”或“逆反应”)进行;欲使起始反应维持向该方向进行,则x的取值范围为 。
(3)若已知ΔH 1<0,ΔH 2<0, x分别为6.5和7.0时,在这两种情况下,反应分别达到平衡状态(Ⅱ)时,请比较H2体积分数(分别记作φ(H2)、φ(H2’))的相对大小 。
A.φ(H2)>φ(H2’) B.φ(H2)<φ(H2’)
C.φ(H2)=φ(H2’) D.不能确定
(4)若x=6.5时,左右两侧反应体系达平衡后,设法向左侧容器中再充入a mol氢气,当左、右两侧反应体系再次平衡时(隔板平衡点位置不变,下同)a的取值范围是 。
(5)若x=6.5时,且左右两侧反应体系均达到平衡后,如向右侧反应体系中充入b mol氦气,片刻后,使容器两侧又均达到平衡。则右侧化学平衡将向 方向(填“正反应”或“逆反应”)移动;b的最大值应小于 。
利用下图所示的装置,可以验证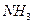 和HCl的有关性质。实验前a、b、c活塞均关闭。
和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)通过挤压胶头滴管和控制活塞的开关,若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是
(2)通过挤压胶头滴管和控制活塞的开关,在烧瓶l中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是
我国著名化学家傅鹰告诫我们“化学给人以知识,化学史给人以智慧。”回顾苯的结构的探索历程,曾有人提出两种立体结构:就上述两种立体结构回答下列有关问题:
(1) 若苯的结构为(Ⅰ),则在下列项目中它与苯的凯库勒式结构不同的是__________
a.一氯代物种数 b.二氯代物种数
c.与溴水的作用 d.燃烧时烟的浓度
(2) 利用苯的结构(Ⅰ)能解释下列事实的是__________
a.不能使酸性高锰酸钾溶液褪色 b.苯的邻位二氯代物没有同分异构体
c.在一定条件下能和氢气发生加成反应 d.和氯气在一定条件下发生取代反应
(3) 若苯的结构为(Ⅱ),则苯能否使溴水反应褪色?若能,请写出一个可能反应的化学方程式;若认为不能,请说明原因。
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。
乙酸乙酯的实验室和工业制法常采用如下反应:
请根据要求回答下列问题:
⑴欲提高乙酸的转化率,可采取的措施有:、等。
⑵若用上图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为:
、等。
⑶此反应以浓硫酸为催化剂,可能会造成、等问题。
⑷目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 |
同一反应温度 |
||||
| 反应温度/℃ |
转化率(/%) |
选择性(/%)* |
反应时间/ | 转化率(/%) |
选择性(/%)* |
| 40 |
77.8 |
100 |
2 |
80.2 |
100 |
| 60 |
92.3 |
100 |
3 |
87.8 |
100 |
| 80 |
92.6 |
100 |
4 |
92.3 |
100 |
| 120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列(填字母)为该反应的最佳条件。
| A. | 120 ℃,4 | B. | 80 ℃,2 | C. | 60 ℃,4 | D. | 40 ℃,3 |
②当反应温度达到120 ℃时,反应选择性降低的原因可能为。
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有
、
、
、
和
等杂质,提纯工艺路线如下:
| 1. |
写出 脱水反应的热化学方程式。 |
利用如图所示的装置和其他必要的仪器用品,完成下列实验。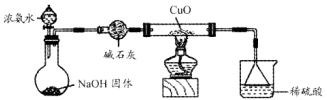
(1)证明氨气具有还原性。已知2NH3+3CuO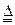 N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是,稀硫酸的作用是。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?
。
③证明NH3具有还原性的实验现象是。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了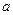 mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。
。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是。