下列配制的溶液浓度偏高的是
| A.配制盐酸用量筒量取盐酸时俯视刻度线 |
| B.配制盐酸定容时,仰视容量瓶刻度线 |
| C.称量4 g NaOH配制0.1 mol/L NaOH溶液1000 mL时,砝码错放左盘 |
| D.NaOH溶解后未经冷却即注入容量瓶至刻度线 |
已知0.1mol某单质与足量的硫在一定条件下充分反应后,质量增加了1.6g,则该单质可能是( )
| A.钙 | B.铜 | C.铁 | D.铝 |
灼烧绿矾的反应方程式如下:
2(FeSO4·7H2O)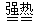 Fe2O3+SO2↑+ SO3↑+ 14H2O
Fe2O3+SO2↑+ SO3↑+ 14H2O
将生成的气体通入BaCl2溶液中,下列叙述中正确的是()
| A.有BaSO4生成 | B.有BaSO3生成 |
| C.同时有BaSO4和BaSO3生成 | D.有SO3逸出 |
下列物质呈固态时必定属于分子晶体的是( )
| A.非金属氧化物 | B.金属氧化物 | C.非金属单质 | D.常温下呈气态的物质 |
在10L的容器中进行如下反应:N2 + 3H2 = 2NH3,3s后,NH3的物质的量增加0.12mol,用H2浓度的变化表示3s内的平均反应速率为()
| A.0.003mol•(L•s)-1 | B.0.045 mol•(L•s)-1 |
| C.0.006 mol•(L•s)-1 | D.0.009 mol•(L•s)-1 |
下列各组物质中,都是共价化合物的是()
| A.H2S和Na2O2 | B.H2O2和CaF2 | C.NH3和N2 | D.HNO3和HClO3 |