常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定不含有的阳离子是_________;所含阴离子相同的两种盐的化学式是________。
(2)M的化学式为_____________,M溶液显碱性的原因是_____________(用离子方程式表示)。
(3)X和Z的溶液反应的离子方程式是__________;
N和氨水反应的离子方程式是______________。
(4)若要检验Y中所含的阳离子,正确的实验方法是____________。
研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为________而存在于土壤中。处于研究阶段的化学固定
新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H K①
已知:N2(g)+3H2(g)=2NH3(g)△H1=-92.4kJ·mol-1 K1②
2H2(g) +O2(g) =2H2O(l)△H2=-571.6kJ·mol-1 K2③
则△H =________;K=___________(用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 |
第一组 |
第二组 |
第三组 |
第四组 |
| t/℃ |
30 |
40 |
50 |
80 |
| NH3生成量/(10﹣6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
下列能说明反应①达到平衡状态的是_____(填字母)。
a.NH3和O2的物质的量之比为4∶3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___________;第四组反应中以NH3表示的反应速率是__________________,与前三组相比,NH3生成量最小的原因可能是_________________。
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如下: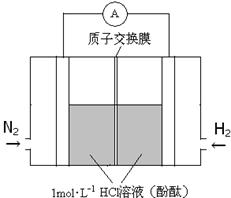
则开始阶段正极反应式为_____________;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH = 7时,溶液中NH3·H2O的浓度为___________( Kb=2×10-5mol·L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为_________________。
【化学——有机化学基础】
下述反应是有机合成中常见的增长碳链的方法:
(1)有关化合物I的说法正确的是________。
| A.可发生取代、氧化等反应 |
| B.1mol化合物I最多能与4mol H2加成 |
| C.易溶于水、乙醇等溶剂 |
| D.属于芳香族化合物 |
(2)化合物Ⅱ的分子式为__________,lmol化合物Ⅱ与NaOH溶液反应最多消耗_____________mol NaOH.
(3)化合物III可与乙酸制备化合物Ⅱ,写出符合下列要求的III的同分异构体的结构简式______________.
a:遇FeCl3溶液显紫色b:核磁共振氢谱有3组峰
(4)利用此增长碳链的方法,写出以甲苯为原料,制备 的化学方程式_____________________,_____________________。
的化学方程式_____________________,_____________________。
【化学—物质结构与性质】
碳是形成化合物种类最多的元素。
(1)C、N、O三种元素的第一电离能由大到小的顺序为______,碳的最简单气态氢化物中心原子的杂化类型为___________。
(2)类肉素[(SCN)2]的结构式为N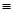 C—S—S—C
C—S—S—C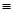 N。其分子中
N。其分子中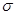 键和
键和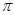 键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C
键的个数比为__________;该物质对应的酸有两种,理论上硫氰酸(H—S—C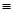 N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
N)的沸点低于异硫氰酸(H—N=C=S)的沸点,其原因是___________________。
(3)位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同的元素,其基态原子的价层电子排布式为 ____________。
(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能,其晶胞结构如图所示(其中·为碳原子,○为硅原子)。每个碳原子周围与其距离最近的硅原子有_____个;设晶胞边长为a cm,密度为b g·cm-3,则阿伏加德罗常数可表示为__________(用含a、b的式子表示).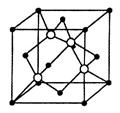
【化学——化学与技术】火山喷发所产生的硫磺可用于生产重要的化工原料——硫酸。某企业用下图所示的工艺流程生产硫酸:
请回答下列问题:
(1)①为充分利用反应放出的热量,转化器中应安装______(填设备名称)。吸收塔中填充有许多瓷管,其作用是________;
②为使硫磺充分燃烧,经流量计l通入燃烧室的氧气过量50%。为提高SO2转化率,经流量计2的氧气量为转化器中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计l和流量计2的空气体积比应为______。b管排出的尾气的处理方法是________.
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是_________(填字母序号)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废气减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛;其中可应用于下列哪些方面__________(填字母序号)。
A.橡胶的硫化B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式___________________________
铁、铝及其化合物的应用十分广泛,请回答:
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有____________(填字母序号)。
A.可燃性B.氧化性 C.还原性
(2)已知:当Al(NO3),溶液中pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式_________________。
(3)氯化铁溶液常用作印刷电路铜板的腐蚀剂,反应的离子方程式为___________;从腐蚀废液中回收金属铜还需要的试剂是__________。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),溶液中铁元素的存在形式为________(填离子符号),检验该离子的实验操作、现象和结论是_________;参加反应的铁粉的质量为______________。