【选修2:化学与技术】工业上用钛铁精矿(FeTiO3)提炼TiO2的工艺流程如下:

(1)酸浸时为了提高浸出率,请提出一种可行的措施____________。
(2)写出硫酸酸浸溶解钛铁精矿生成TiO2+的离子方程式_________________。
(3)钛铁精矿酸浸后经冷却、结晶得到的副产物A为 。
(4)结晶析出A时,需要保持较高的酸度而不能加水,其原因可能为 。
(5)工业上将TiO2和碳粉混合加热氯化生成的TiCl4,然后在高温下用金属镁还原TiCl4得到金属钛,写出TiO2制备Ti过程的化学方程式: 。
请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷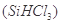 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下: 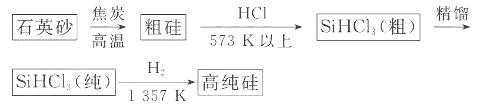
①写出由纯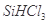 制备高纯硅的化学方程式: ____________________________________。
制备高纯硅的化学方程式: ____________________________________。
②整个制备过程必须严格控制无水无氧。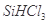 遇水剧烈反应生成
遇水剧烈反应生成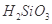 、HCl和另一种物质,配平后的化学反应方程式为___________________________;
、HCl和另一种物质,配平后的化学反应方程式为___________________________;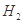 还原
还原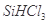 过程中若混入
过程中若混入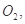 可能引起的后果是____________________________________。
可能引起的后果是____________________________________。
(2)下列有关硅材料的说法正确的是_________ (填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,振荡。写出实验现象并给予解释。
为了探究三种气态氧化物(SO2、NO2、CO2)的性质,某同学设计了一组实验:
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯中,一段时间后,观察到的现象如图A、B、C所示。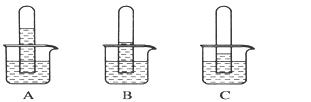
(1)在相同条件下,三种气体在水中溶解度最大的是________(写化学式)写出A烧杯中发生反应的化学方程式:____。如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是_____________________。
实验二:用三只集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。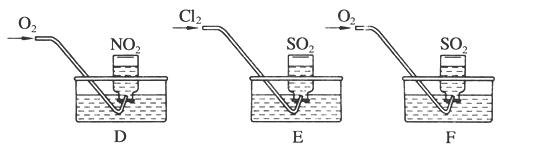
(2)实验二中装置D的集气瓶最终充满溶液(假设瓶内液体不扩散):
①写出装置D中总反应的化学方程式:
_______________________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________________。
(3) 写出实验F通入氧气后,发生反应的化学方程式:____________________________。
(4)溶液充满集气瓶后,在E装置的水槽里滴加硝酸钡溶液,可能观察到的现象为________,用有关的离子方程式解释原因:________________________。
材料是科学技术进步的关键,是科学技术和社会发展的物质基础。材料的发展不仅影响了人类的昨天和今天,而且还将影响到人类的明天。请回答以下与材料有关的问题。
(1)无机非金属材料。单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿。其主要用途是用做半导体材料和利用太阳能光伏发电、供热等。单晶硅的制备方法如下: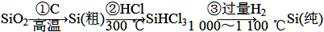
①写出步骤①的化学方程式:______________________。
②已知以下几种物质的沸点:
| 物质 |
SiHCl3 |
SiCl4 |
HCl |
| 沸点 |
33.0 ℃ |
57.6 ℃ |
-84.7 ℃ |
在步骤②中提纯SiHCl3所进行的主要操作的名称是________。
(2)金属材料。金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。包括纯金属、合金和特种金属材料等。
①下列物质中不属于合金的是( )。
A.钢铁 B.青铜 C.硬铝 D.水银
②铜器制品常因接触空气中的O2、CO2和H2O而易生成铜锈。试写出保护铜制品的方法:___________________________________________________。
(3)纳米材料,胶体粒子的直径大约是________,与纳米材料的尺寸相当。实验室制取Fe(OH)3胶体溶液的方法是_________________________________,
用________方法消除胶体中的浑浊,根据________现象证明胶体已经制成。实验中必须要用蒸馏水,而不能用自来水,其原因是____________________。
(4)磁性材料。某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26 g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66 g白色沉淀、过滤、在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。①该磁性粉末中氧元素的质量分数为________;②该材料的化学式为________。
化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2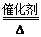 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
| 注意事项 |
理由 |
|
| ① |
______________ |
____________ |
| ② |
________________ |
____________ |
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的。图中M(C3H4O)和A均能发生银镜反应。N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种。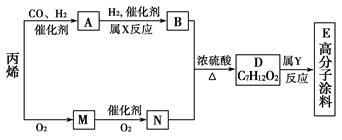
试写出:
(1)下列物质的结构简式:
A________;M________;E________。
(2)物质A的同类别的同分异构体的结构简式为______________。
(3)反应类型:X______________;Y__________________。
(4)写出D→E的化学方程式:____________________。