【化学-选修2:化学与技术】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用如图所示的工艺流程生产硫酸:

请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装 (填设备名称),吸收塔中填充有许多瓷管,其作用是 .
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为 .假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 (空气中氧气的体积分数按0.2计),该尾气的处理方法是 .
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是 (可多选).
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面 .
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式 .
合成氨是人类科学技术上的一项重大突破,其反应原理为:
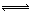
一种工业合成氨的简易流程图如下: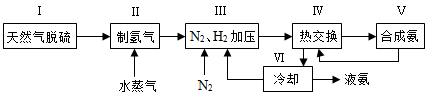
(1)天然气中的
杂质常用常用氨水吸收,产物为
。一定条件下向
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:。
(2)步骤II中制氯气原理如下:
①
②
对于反应①,一定可以提高平衡体系中
百分含量,又能加快反应速率的是。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将
进一步转化,可提高
产量。若1
和
的混合气体(
的体积分数为20%)与
反应,得到1.18mol
、
和
的混合气体,则
转化率为。
(3)下左图表示500
、60.0
条件下,原料气投料比与平衡时
体积分数的关系。根据图中
点数据计算
的平衡体积分数:。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,
物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号),简述本流程中提高合成氨原料总转化率的方法:。
从薄荷油中得到一种烃
,叫
-非兰烃,与
相关反应如下: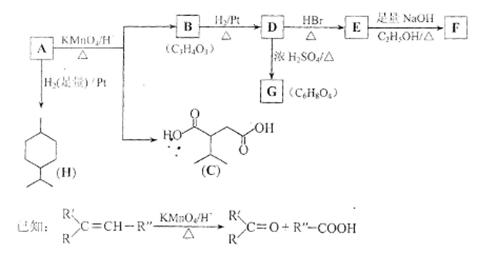
(1)
的分子式为。
(2)
所含官能团的名称为。
(3)含两个
基团的
的同分异构体共有种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为。
(4)
,
的反应类型分别为、。
(5)
为含六元环的化合物,写出其结构简式:。
(6)
在一定条件下发生聚合反应可得到一种高级吸水性树脂,该树脂名称为。
(7)写出
的化学方程式:。
(8)
的结构简式为,
与等物质的量的
进行加成反应的产物共有种(不考虑立体异构)。
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为,氧化性最弱的简单阳离子是。
(3)已知:
| 化合物 |
||||
| 类型 |
离子化合物 |
离子化合物 |
离子化合物 |
共价化合物 |
| 熔点/℃ |
2800 |
2050 |
714 |
191 |
工业制镁时,电解
而不电解
的原因是;制铝时,电解
而不电解
的原因是。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出
的电子式:;在上述由
制纯硅的反应中,测得每生成1.12
纯硅需吸收
热量,写出该反应的热化学方程式:。
(5)
是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用
干燥的是。
a.
b.
c.
d .
(6) 可用于实验室制 ,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:。
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为
,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
,又制得电池材料
(反应条件已略去)。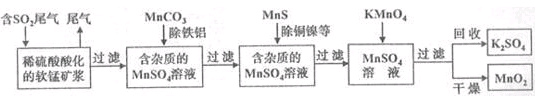
请回答下列问题:
(1)上述流程脱硫实现了(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用
能除去溶液中
和
,其原因是。
(3)已知:25℃、101
时,
与
反应生成无水
的热化学方程式是。
(4)
可作超级电容器材料。用惰性电极电解
溶液可制得
,其阳极的电极反应式是。
(5)
是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是。
(6)假设脱除的
只与软锰矿浆中的
反应。按照图示流程,将
(标准状况)含
的体积分数为
%的尾气通入矿浆,若
的脱除率为89.6%,最终得到
的质量为
,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于
。
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是。
(2)XY2-离子的立体构型是;R2+的水合离子中,提供孤电子对的是原子是。
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是。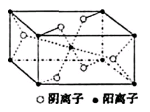
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是。