常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.通入过量SO2气体后的溶液:H+、Ca2+、Fe3+、NO3- |
| C.通入足量CO2的溶液:H+、NH4+、Al3+、SO42- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法错误的是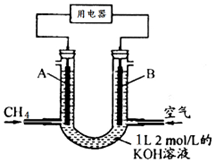
A.通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+2KOH=K2CO3+3H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32- +3H2O=10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为: c(CO32- )>c(HCO3- )>c(OH-)
下列关于①乙烯;②苯;③乙醇;④乙酸;⑤葡萄糖等有机物的叙述不正确的是
| A.可以用新制的Cu(OH)2悬浊液鉴别③④⑤ |
| B.只有①③⑤能使酸性KMnO4溶液褪色 |
| C.只有②③④能发生取代反应 |
| D.一定条件下,⑤可以转化为③ |
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
| 温度/℃ |
25 |
80 |
230 |
| 平衡常数 |
5×104 |
2 |
1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)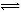 Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
| A.①④ | B.①②④ | C.①②④⑤ | D.①②③④ |
下列关于有机物的说法中正确的是
| A.2013年11月山东现“夺命快递”——化学品泄漏致1死7中毒。该化学品为氟乙酸甲酯,它是一种无色透明液体,不溶于水,易溶于乙醇、乙醚。它属于酯类,也属于卤代烃 |
B.按系统命名法,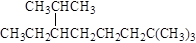 的名称为2,7,7-三甲基-3-乙基辛烷 的名称为2,7,7-三甲基-3-乙基辛烷 |
| C.甲基环己烷环上一氯代物的同分异构体共有3种 |
| D.某种醇在适当条件下与足量的乙酸发生酯化反应,生成的酯的相对分子质量a与原来醇的相对分子量b的关系是a=b+84,则该醇分子中具有两个醇羟基 |