下列实验结论正确的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
取待测液先进行焰色反应,再加足量稀盐酸,将产生气体通入品红溶液 |
火焰呈黄色,品红溶液褪色 |
原溶液一定是亚硫酸钠溶液 |
| B |
向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液 |
苯酚钠溶液中出现白色浑浊 |
说明酸性:醋酸>碳酸>苯酚 |
| C |
常温下向足量浓度较大的硫酸和稀硫酸中,分别加入相同质量、相同体积的铁片 |
相同时间两者产生H2速率不同[来 |
反应物的浓度越大,反应速率越快 |
| D |
相同的铝片分别与同温同体积,且c(H+)="1" mol·L¯1的盐酸、硫酸反应 |
铝与盐酸反应产生气泡较快 |
可能是Cl-对该反应起到促进作用 |
下列有关SiO2的叙述正确的是
| A.SiO2不与任何酸反应 |
| B.玻璃中含有SiO2,所以不能用玻璃瓶盛装稀氢氧化钠溶液 |
| C.SiO2是酸性氧化物,能与NaOH反应 |
| D.SiO2能与水反应生成硅酸 |
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.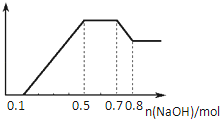
则下列说法正确的是
| A.溶液中一定不含CO32﹣,可能含有SO42﹣和NO3﹣ |
| B.溶液中n(NH4+)=0.2mol |
| C.溶液中的阳离子只有H+、Mg2+、Al3+ |
| D.n(H+):n(Al3+):n(Mg2+)=1:1:1 |
下列说法不正确的是
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
| A.①④ | B.①④⑤ | C.①②③④ | D.①②③④⑤ |
下列离子方程式正确的是
| A.FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Cl﹣+2Fe3+ |
| B.大理石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O |
| C.向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O |
| D.为了除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理:Ca2++CO32﹣═CaCO3↓ |
图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.已知:2KMnO4+16HCl→2KCl+5Cl2↑+2MnCl2+8H2O,对实验现象的“解释或结论”正确的是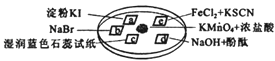
| 选项 |
实验现象 |
解释或结论 |
| A |
a处变蓝,b处变红棕色 |
氧化性:Cl2>Br2>I2 |
| B |
c处先变红,后褪色 |
氯气与水生成了酸性物质 |
| C |
d处立即褪色 |
氯气与水生成了漂白性物质 |
| D |
e处变红色 |
还原性:Fe2+>Cl﹣ |