某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:
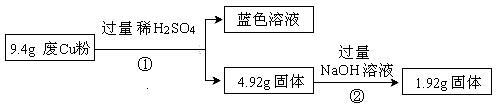
(1)废Cu粉中一定含有的杂质是 (填化学式)。
(2)写出过程②发生反应的离子方程式: 。
过程Ⅱ:
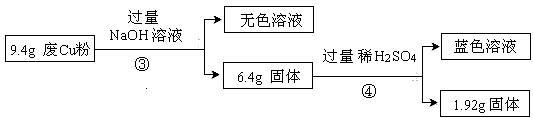
(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是 (化为最简整数比)
过程Ⅲ:已知25℃时:
| 电解质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积(Ksp) |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 开始沉淀时的pH |
5.4 |
6.5 |
3.5 |
| 完全沉淀时的pH |
6.4 |
9.6 |
4.0 |
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2溶液,调节溶液的pH范围为 ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与 Ⅲ方案 相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+ 氧化为Fe3+ 的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
某溶液A,可能含有等物质的量浓度的SiO32-、CO32-、SO32-、S2-、AlO2-、Cl-、PO43-中的几种,现进行以下实验:
(1)以10mLA溶液,往其中通入足量的CO2,得到白色沉淀B,B可完全溶于稀硫酸。
(2)另取10mLA溶液,往其中加入稀硫酸,生成气体C,将C通入Pb(NO3)2溶液中,有黑色沉淀D生成。
问题:
(1)溶液A中肯定存在:_____________________________________.
(2)溶液A中肯定不存在:______________________________,其理由是:___________________.
有一瓶无色气体,可能含有HCl、H2S、CO2、HBr、SO2中的一种或几种,将其通入氯水中得无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀,以下结论正确的是……( )
①原气体中肯定有SO2,②原气体中可能有SO2,③原气体中肯定没有H2S、HBr,④不能肯定原气体中是否含有HCl,⑤原气体中肯定无CO2,⑥原气体中肯定有HCl.
| A.①③④ | B.②④ | C.①③⑥ | D.①③⑤⑥ |
某溶液中含有较多的Na2SO4和少量的 Fe2(SO4)3。若用该溶液制取芒硝(Na2SO4·10H2O),可供选择的操作有:
①加适量H2SO4溶液;②加金属钠;③结晶;④加过量NaOH;⑤加强热脱结晶水;⑥过滤。正确的操作步骤是
| A.②⑥③ | B.④⑥①③ | C.④⑥③⑤ | D.②⑥①③⑤ |
在做氨的催化氧化实验时,铂丝不能接触氨水,原因是…( )
| A.铂丝的温度高,接触氨水会使氨气大量逸出 | B.红热铂丝会与氨水反应,使铂丝腐蚀 |
| C.防止铂丝温度降低而不能起催化作用 | D.防止爆炸 |
某学生的实验报告有如下数据:①用托盘天平称取11.7g食盐;②用量筒量取21.48mL盐酸;③用容量瓶配制210mL1mol/L的硫酸溶液;④用标准NaOH溶液滴定未知浓度的盐酸,用去18.20mLNaOH溶液,其中数据合理的是……()
| A.①④ | B.②④ | C.①③ | D.②③ |