碳元素在自然界中分布很广,在地壳中其丰富程度位列第14位,远低于氧、硅、铝、铁等元素。但是,碳却是存在形式最复杂的元素,如煤、石油、天然气、动植物体、石灰石、白云石、二氧化碳等。请回答下列问题:
(1)基态碳原子的电子排布式为 。
(2)在CO2分子中,碳原子采用 杂化轨道与氧原子成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键,应用价层电子对互斥理论,预测COCl2分子的空间构型为 。
(4)二茂铁(5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,实验室测定铁的含量:可用配位剂邻二氮菲(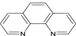 ),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有 个。
),它能与Fe2+形成红色配合物(如图1),该配离子中Fe2+与氮原子形成配位键共有 个。
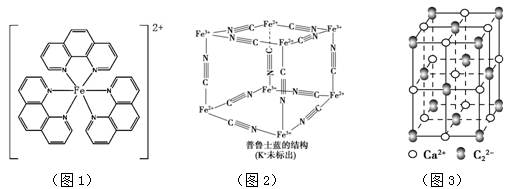
(5)普鲁士蓝可用作染料,它的结构如图2所示。
普鲁士蓝中,n(K+)∶n(Fe3+)∶n(Fe2+)∶n(CN-)= 。
(6)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃C22-的存在,使晶胞沿一个方向拉长(如图3)。CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 。
已知CaC2晶体密度为ag·cm-3,NA表示阿伏加德罗常数,则CaC2晶胞体积为 cm3。
(13分)(1)A、B、D为短周期元素,请根据信息回答问题:
| 元素 |
A |
B |
D |
| 性质或结构信息 |
工业上通过分离液态空气获得其单质,单质能助燃 |
气态氢化物的水溶液显碱性 |
原子有三个电子层,简单离子在本周期中半径最小 |
①第一电离能:AB(填“>”、“=”、“<”),基态D原子的电子排布式为。
②B和D由共价键形成的某化合物BD在2200℃开始分解,BD的晶体类型为。
(2)发展煤的液化技术被纳入“十二五规划”,中科院山西煤化所关于煤液化技术的高效催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH),从而实现液化。
①某含铜离子的离子结构如右图所示:
在该离子内部微粒间作用力的类型有:(填字母)。
A.离子键 B.极性键 C.非极性键 D.配位键 E.范德华力 F.氢键
②煤液化获得甲醇,再经催化得到重要工业原料甲醛(HCHO),甲醇的沸点为65℃,甲醛的沸点为-21℃,两者均易溶于水。甲醇的沸点比甲醛高是因为甲醇分子间存在着氢键,而甲醛分子间没有氢键。甲醇和甲醛均溶于水,是因为它们均可以和水形成分子间氢键。请你说明甲醛分子间没有氢键的原因是。
③甲醇分子中,进行sp3杂化的原子有,甲醛与H2发生加成反应,当生成1mol甲醇时,断裂的∏键的数目为
T、X、Y、Z、Q、R、W为周期表前四周期的元素,原子序数依次递增。已知:
①W的原子序数为29,其余元素均为短周期主族元素;
②T原子所处的周期数、族序数分别与其原子序数相等;
③X的基态原子电子占据三种能量不同的轨道,且每种轨道中的电子数相同;
④Z的基态原子价电子排布为ns2npn+2;
⑤在该元素所在的周期中,Q的基态原子的第一电离能最小;
⑥R的单质常温常压下是气体,其基态原子的M层上有1个未成对的p电子;
(1)X、Y、Q三种元素的电负性由大到小的顺序是(用元素符号表示)。
(2)与W同周期的元素中,原子最外层电子数与W元素原子相同的元素还有(填元素符号)。由W2+制取[W(YT3)4]2+的离子方程式为。
(3)T、X、Z三种元素组成的一种化合物M是蚂蚁分泌物和蜜蜂的分泌液中含有的物质,俗称蚁酸,它的分子式为XT2Z2,则该分子的X原子采取杂化,1mol M分子中δ键和π键的个数比为。
(4)X和Y原子结合形成的X3Y4晶体,其晶体结构与金刚石类似,但硬度比金刚石大,其原因是。
把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) ="==" CO2(g)
途径II:先制水煤气: C(s) + H2O(g) ="==" CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g)="==" 2CO2(g); 2H2(g)+O2(g) ===2H2O(g)
已知:①C(s)+O2(g)===CO2(g);△H1=-393.5kJ·mol-1
②H2(g)+ O2(g)=H2O(g);△H2=-241.8kJ·mol-1
O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+  O2 (g)=CO2(g);△H3=-283.0kJ·mol-1
O2 (g)=CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C(煤)的标准燃烧热是
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是 (单选)
| A.途径II制水煤气时增加能耗,故途径II的做法不可取 |
| B.与途径I相比,途径II可以减少对环境的污染 |
| C.与途径I相比,途径II可以提高煤的燃烧效率 |
| D.将煤转化为水煤气后,便于通过管道进行运输 |
某同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如下图所示的装置,一次性完成S、C、Si三种元素的非金属性强弱的判断实验。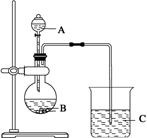
(1)写出A、B、C三处所用的化学药品的名称是:
A_________, B________,C_________。
(2)写出该同学所设计的实验原理所涉及的离子方程式:
①
②
(3)能证明非金属性S>C>Si的实验现象是:
。
A、B、C、D为短周期的主族元素,它们的原子序数依次增大。A和C的原子最外层电子数相等;C+阳离子与Ne原子的电子层结构相同;B、D同主族,B元素原子的最外层电子数是内层电子数的3倍;A与B能形成A2B及A2B2两种化合物,其在常温常压下均呈液态。请回答下列问题:
(1)C2B2中含有的化学键是。
(2)化合物A2B2的电子式是。
(3)A、B、C、D离子半径由大到小的顺序为(用离子符号表示)。
(4)用电子式表示化合物A2B的形成过程:。