三苯甲醇是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。

 |
已知:(I)格氏试剂容易水解:
(Ⅱ)相关物质的物理性质如下:
| 物质 |
熔点 |
沸点 |
溶解性 |
| 三苯甲醇 |
164.2℃ |
380℃ |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 |
-116.3℃ |
34.6℃ |
微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 |
-30.7℃ |
156.2℃ |
不溶于水,溶于乙醇、乙醚等有机溶剂 |
(Ⅲ)三苯甲醇的相对分子质量是260。
请回答以下问题:
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
 (3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:
其中,洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。
植物精油具有抗菌消炎、解热镇痛等药物功用。从樟科植物枝叶中提取的精油中含有下列甲、乙、丙三种成分: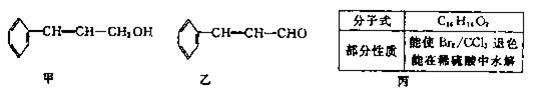
(1)甲、乙中含氧官能团的名称分别为、。
(2)经下列过程甲可转化为乙: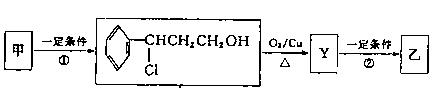
①,②的反应类型分别为、。
(3)通过下列合成路线由乙可得到丙(部分反应产物略去)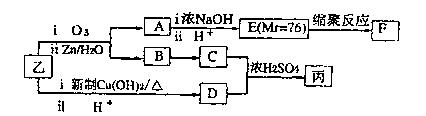
已知: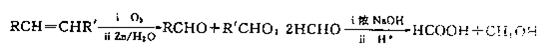
①F的结构简式为。
②由乙制取D的化学方程式为。
③写出同时符合下列要求的D的同分异构体的结构简式。
a.化合物是二取代苯
b.分子中有5种不同环境的氢原子,其个数比为l:2:2:1:2
c.能使溴的CCl4溶液退色,且在酸性条件下可以发生水解反应
④丙的结构简式为。
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究氯气与碳酸钠反应得到的固体物质。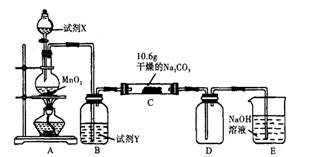
⑴写出装置A中发生反应的化学方程式:
⑵写 出试剂Y的名称:
出试剂Y的名称:
⑶已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有碳酸氢钠,现对C成分进行猜想和探究。①提出合理假设。
假设1:存在两种成分:Na HCO3和;
假设2:存在三种成分:Na HCO3和、;
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。限选实验试剂和仪器:蒸馏水、稀硝酸、氯化钡溶液、澄清石灰水、硝酸银溶液、试管、小烧杯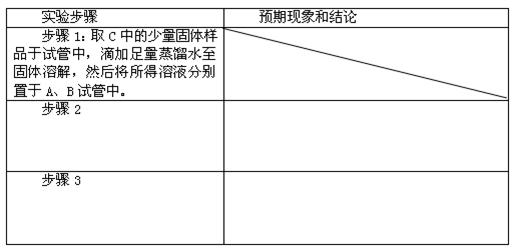
⑷根据上述实验现象,有同学得出“干燥的氯气能和碳酸钠固体反应”的结论。该结论严密吗?为什么?
⑸若C中有0.1molCl 2恰好与装置中Na 2CO3完全反应,且假设1成立,可推知C中反应的化学方程式为:
(1)某化学小组的同学在学习了NaHCO3和Na2CO3的有关知识后,进行如下实验:在两支试管中分别加入3mL4 mol·L-1稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下: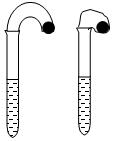
①试管中(填产生沉淀或气体及反应速率等相关现象)____________。
②盛______________的试管中气球变得更大,大小气球体积之比约为(填简单整数比)____________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3
的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g);△H>0
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g);△H<0
甲下结论的方法是否正确____________(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
| 序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
| ① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
| ② |
35mL水 |
3.2g Na2CO3固体 |
20℃ |
24.3℃ |
| ③ |
35mL 稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
| ④ |
35mL 稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1 mL+10ml水 |
20℃ |
24.2℃ |
| ⑤ |
35mL 稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
| ⑥ |
35mL 稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《_____________________________________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为_________和__________;通过上述实验可得出五条结论(用“吸热”或“放热”填写):
a:NaHCO3的溶解是_______过程;
b:Na2CO3的溶解是_______过程;
c:NaHCO3的饱和溶液和盐酸的反应是____________反应;
d:Na2CO3的饱和溶液和盐酸的反应是____________反应;
e:NaHCO3固体与稀盐酸反应的反应热是______(填a、b、c、d中的字母)的热效应之和。
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有_________________(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_______(填“是”“否”“不能确定”)。
(3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。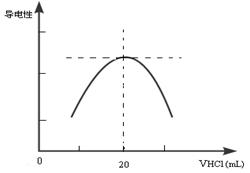
写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+浓度下降,这样,恰好完全反应时NH4+浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
实验室用下图装置制取少量溴苯,试填写下列空白。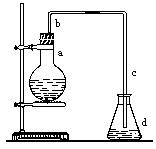
(1)在烧瓶a中装的试剂是、、。
(2)请你推测长直导管b的作用是 。
(3)请你推测导管c的下口可否浸没于液面中
(4)写出烧瓶a中所有反应的方程式(标明条件)并指出有机反应类型________。