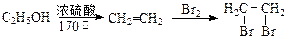向炭粉、Cu和Fe2O3组成的混合粉末中加入一定量的稀硫酸,充分反应后过滤,得到溶液A,将沉淀物洗涤、干燥,得到固体B。
(1)碳的原子结构示意图为 ,氧元素在周期中的位置是 。
(2)加入稀硫酸后,发生反应的离子方程式 ,溶液A中一定存在的金属阳离子是 。
(3)关于固体B的成分,下列选项中可能的有 。
A.炭粉
B.炭粉和Cu
C.炭粉和Fe2O3
D.Cu和Fe2O3
E.炭粉、Cu和Fe2O3
.电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置(E中电炉省去)。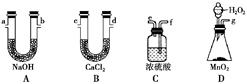
(1)产生的氧气按从左到右的流向,所选装置各导管的连接顺序是__________________。
(2)C装置中浓H2SO4的作用是__________________。
(3)D装置中MnO2的作用是____________________。
(4)E燃烧管中CuO的作用是______________________。
(5)若准确称取0.90 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32 g,B管质量增加0.54 g,则该有机物的最简式为_____________________ (3分)。
(6)要确立该有机物的分子式,还要知道________________________________________。
.随着现代工业的发展,能源问题已经越来越引起人们的重视,科学家预言,未来最理想的燃料是绿色植物,即将植物的秸秆(主要成分是纤维素)用适当的催化剂可以水解成葡萄糖,再将葡萄糖转化为乙醇,用做燃料。
(1)写出绿色植物的秸秆转化为乙醇的化学方程式:
①____________________________________
②________________________________________。
(2)乙醇除用做燃料外,还可以用它合成其他有机物,以乙醇为起始原料的转化关系如图所示:(已知;在有催化剂的条件下,多步氧化R-CH2OH→R-CHO→RCOOH)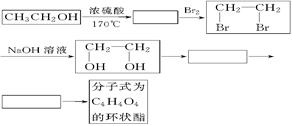
请在方框中填上相应物质的结构简式。
(3)写出上面转化关系图中由CH2OHCH2OH―→C4H4O4的化学方程式(有机物用结构简式表示)。
(9分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式______________________________________.
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热化学方程式___________________.
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l ) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______________________.
.除去下列物质中含有的少量杂质,请填写应加入的试剂及操作方法:
| 组别 |
物质 |
杂质 |
试剂 |
操作方法 |
| A |
乙烷 |
乙烯 |
||
| B |
溴苯 |
溴 |
||
| C |
硝基苯 |
硝酸 |
||
| D |
CO2 |
HCl |
(10分)
苯佐卡因可用于粘膜溃疡、创面等的镇痛,是一种常用的局部麻醉剂,其合成路线如下图所示: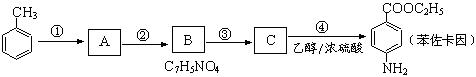
已 知:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。
知:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。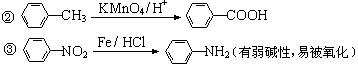
请回答下列问题:
(1)上述合成路线中属于取代反应的是 (填代号)。
化合物C 中含有的含氧官能团的名称为 。
中含有的含氧官能团的名称为 。
(2)合成路线中反应①的化学方程式为 。
(3)下列关于上述合成路线的说法中正确的是 。(填字母)
a.反应①除主要生成物质A外,还可能生成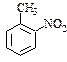 、
、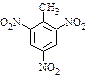 等
等
b.步骤①和②可以互换c.反应③是还原反应
(4)苯佐卡因有多种同分异构体,请写出其中任意一种满足下列条件的同分异构体的结构简式: 。
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。
(5)化合物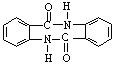 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。
提示:① 合成过程中无机试剂任选;②合成路线流程图示例如下:
合成过程中无机试剂任选;②合成路线流程图示例如下: