下列说法错误的是
| A.浓硫酸具有强氧化性,但SO2气体可以用浓硫酸干燥 |
| B.常温下实验室可以用稀硝酸与铁反应制取NO气体 |
| C.王水溶解金的过程为氧化还原反应,还原产物为NO2 |
| D.SiO2不仅能与氢氧化钠溶液反应,也能与氢氟酸反应 |
NA表示阿伏加德罗常数,下列判断正确的是( )
| A.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol·L |
| B.100 mL 1 mol·LAlCl3溶液中含的阳离子数大于0.1NA |
| C.标准状况下,22.4 L二氯甲烷的分子数均为NA |
| D.含0.2 molH2SO4的浓硫酸与足量的铜反应,生成的SO2的分子数为0.1 NA |
下列A~D 4组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是( )
| Ⅰ |
Ⅱ |
|
| A |
少量SO2通入Ba(OH)2溶液中 |
过量SO2通入少量Ba(OH)2溶液中 |
| B |
少量浓氨水滴入Al2(SO4)3溶液中 |
少量Al2(SO4)3溶液滴入浓氨水中 |
| C |
0.1 mol Cl2通入含0.2 mol FeBr2的溶液中 |
0.3 mol Cl2通入含0.2 mol FeBr2的溶液中 |
| D |
过量稀硝酸与少量铁屑混合 |
少量稀硝酸与过量铁屑混合 |
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
| A.NH4+、Ba2+、Cl-、NO3- | B.K+、AlO2-、Cl-、SO42- |
| C.Ca2+、Mg2+、NO3-、HCO3- | D.Na+、Cl-、CO32-、SO32- |
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。下列说法中不正确的是( )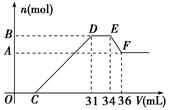
| A.合金与硝酸反应时硝酸过量 |
| B.合金中铝的物质的量为0.008 mol |
| C.合金中金属的物质的量共为0.032 mol |
| D.无法求出C点的值 |
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则( )
| A.反应过程中得到6.72 L的气体(标况) |
| B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C.最终得到7.8 g的沉淀 |
| D.最终得到的溶液中c(NaCl)=0.15 mol/L |