某学生欲配制6.0 mol/L的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:①480 mL 0.5 mol/L的硫酸;②150 mL 25%的硫酸(ρ=1.18 g/mL);③足量的18 mol/L的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为____________mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为____________mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol/L的浓硫酸____________mL,沿玻璃棒倒入上述混合液中,并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.____________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1 cm~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?____________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意______________________。
海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是__________(从下列仪器中选出所需仪器,用标号字母填写在空白处);
A 烧杯 B 坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_____________;步骤⑥的目的是从含碘苯溶液中分离出单质碘,同时回收苯,该步骤的实验操作名称是__________________;
(3)步骤⑤中,某学生选择用苯来提取碘的理由是,还可选用___________(写试剂的化学式),该步骤所用主要玻璃仪器的名称是____________。
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是:
____________________________________________________________________
(10分)为测定某碳酸氢钠样品纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取m1g样品),请回答每个方案中的问题。
[方案Ⅰ] 选用重量法进行测定:可用下图中的装置进行实验。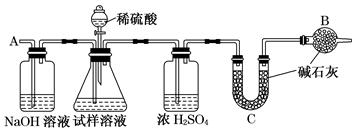
(1)A装置中NaOH溶液的作用是__________________若直接向试样溶液中鼓入空气会导致实验测定结果________(填“偏高”、“偏低”或“无影响”)。
(2)该方案需直接测定的物理量是______________________________________。
[方案Ⅱ] 选用气体体积法进行测定:可用如图中的装置进行实验,为了减小实验误差,量气管中加入饱和NaHCO3溶液。
(3)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象
的原因可能是________。
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的液面高于量气管的液面
c.Y型管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
[方案Ⅲ] 选用滴定法进行测定:
(4)称取m1g样品,配成100 mL溶液,取出20 mL,用c mol·L-1的标准HCl溶液滴定,
消耗体积为VmL,则该试样中碳酸氢钠质量分数的计算表达式为:_________________
实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。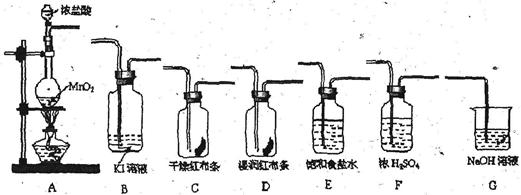
(1)上述装置中各仪器从左至右的连接顺序为A接__接__接__接__接__接G。
(2)E装置的作用是__________,D中的现象为____,B中的现象为_________。
(3)写出相关反应的离子方程式:A中___________,G中______________。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。
(19分)实验室欲用胆矾配制250 mL0.2 mol·L-1的CuSO4溶液。
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A 计算B 称量 C.溶解D.______E. ______F. 定容 G. 摇匀、装瓶
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、量筒还有______
和______(填仪器名称)
(3)经计算需要称取CuSO4·5H2O的质量为______。
(4)若称取胆矾时砝码被放在左盘(10g以下用游码),则配制的CuSO4溶液的浓度______(填“偏高”、“偏低”、“无影响”);若定容时仰视刻度线,则配制的CuSO4溶液的浓度______ (填“偏高”、“偏低”、“无影响”)。
(5)从准确配制好的CuSO4溶液中取出50mL ,则这50mL CuSO4溶液的物质的量浓度为______________,所含Cu2+的质量为。
下图所示是分离混合物时常用的仪器,回答下列问题: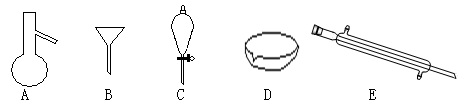
(1)写出仪器C、E的名称、
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①NaCl固体和泥沙:②花生油和水:
(3)若向C装置中加入碘水和足量CCl4,充分振荡后静置,观察到现象是:C内液体分两层,上层液体呈色,下层液体色。
(4)碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是:
A.汽油 B.CCl4C.酒精 D.醋酸