已知难溶于水的盐在水中存在溶解平衡,例如氯化银在水中的溶解平衡为AgCl(s)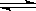 Ag+(aq)+ Cl-(aq)在一定温度下,水溶液中银离子(Ag+)和氯离子(
Ag+(aq)+ Cl-(aq)在一定温度下,水溶液中银离子(Ag+)和氯离子(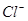 )的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp = c(Ag+)·c(
)的物质的量浓度的乘积为一常数,可用Ksp表示:Ksp = c(Ag+)·c(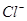 )= 1.8 × 10-10,现把氯化银(足量)分别放入:①100mL蒸馏水中;②100mL 0.1mol·L-1的盐酸溶液中;③1000mL 0.1 mol·L-l的氯化铝溶液中;④100mL0.1 mol·L-1的氯化镁溶液中。
)= 1.8 × 10-10,现把氯化银(足量)分别放入:①100mL蒸馏水中;②100mL 0.1mol·L-1的盐酸溶液中;③1000mL 0.1 mol·L-l的氯化铝溶液中;④100mL0.1 mol·L-1的氯化镁溶液中。
(1)充分搅拌后相同温度下,银离子浓度由大到小顺序是 (填序号)
(2)0.1mol·L-l氯化铝溶液中,银离子的物质的量浓度最大可达到 mol·L-1。
(3)向氯化银的饱和溶液中滴加硫化钾溶液,可观察到的现象是 ,产生此现象涉及的离子方程式为 。
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH—、C1—、CO32—、NO3—、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。试回答下列问题:
(1)写出D为_________________
(2)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:_____________________。
(3)写出E溶液与过量的B溶液反应的离子方程式__________________________。
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=-aKJ·mol-1。请写出B与C的稀溶液反应的热化学方程式______________________________
(5)在100 mL0.1 mol·L-1E溶液中,逐滴加入35 mL 2 mol·L-1NaOH溶液,最终得到沉淀物质的量为_____。
(12分)短周期的四种元素X、Y、Z、W,原子系数依次增大,Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A.B.C,其中化合物C在空气中容易变质,请回答:
(1)写出Z的原子结构示意图______________________________。
(2)写出化合物YZ2电子式:______________空间构形为:_______________,
写出化合物C的电子式:_____________化学键类型有:_____________。
(3)写出化合物C在空气中变质的化学方程式:____________________
(15分)甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下,发生如下反应制得: 。请根据图示回答下列问题:
。请根据图示回答下列问题:
(1)从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________。
(2)写出该反应的热化学方程式________________
(3)恒容条件下,下列措施中能使 增大的有________________
增大的有________________
A升高温度B充人He气
C再充入1molCO和2mol H 2 D使用催化剂
(4)若在温度和容器相同的三个密闭容器中,按不同方式投人反应物.,测得反应达到平衡吋的有关数据如下表:
则下列关系正确的是________
A c1=c2 B. 
C. 2a1=a3 D. a1 +a2 =1
E该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(5)若在一体积可变的密闭容器中充入l mol CO 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动,理由是________________
碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1)NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L—1的氨水,溶液中随着水量的增加而减小的是_____________(填序号)
(2)标准状况下,将1.12LCO2通入100mL1mol·L—1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为_________________________________________________;
①c(OH—)=2c(H2CO3)+______________________________________________;
②c(H+)+c(Na+)=___________________________________________________。
(3)甲烷燃料电池中发生的化学反应为:CH4+2O2=CO2+2H2O,该电池的电解质溶液为H2SO4溶液,则 原电池工作时电解质溶液中向正极移动的离子是_____________。
原电池工作时电解质溶液中向正极移动的离子是_____________。
已知五种短周期元素在周期表中的相对位置如下表所示。
| A |
|||||
| B |
|||||
| c |
d |
e |
(1)上述元素中离子半径最大的是_______________(填写元素符号)。
(2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成。它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和强碱,则:①A、B、E所含的该金属元素的原子结构示意图为_________________________________________;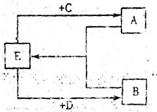
②若将D逐滴滴入A的溶液中至过量,反应过程中的离子方程式依次为______________________________________________________________。