(1)配制100mL 1mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为_________________mL。
(2)等温等压下,等体积的CO2和O3所含分子个数比为 ,原子个数比为 ,密度比为 。
(3)有12.4g Na2R含Na+为0.4mol,则Na2R的摩尔质量为 ,R的相对原子质量为 。
(4)在标准状况下1.7g氨气所占的体积为 L,它与同条件下 mol H2S含有相同的氢原子数。
(5)100mL 0.5mol/L的(NH4)2SO4溶液中含有NH4+___________________mol,这些NH4+中所含有的电子数为___________________。
CYP73A1炔抑制剂的合成路线如下: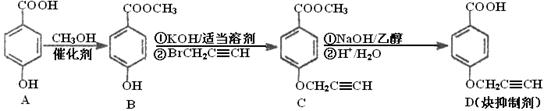
(1)化合物A核磁共振氢谱有____________种蜂。
(2)化合物C中含氧官能团有_______________、______________(填名称)。
(3)鉴别化合物B和C最适宜的试剂是____________________。
(4)写出A—B的化学方程式_____________________________。
(5)B的同分异构体很多,符合下列条件的异构体有______________种。
①苯的衍生物②含有羧基和羟基③分子中无甲基
(6)试以苯酚、氯乙酸钠(ClCH2COONa)、正丁醇为原料(无机试剂任用),结合题中有关信息,请补充完整的合成路线流程图。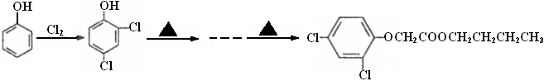
(12分) 氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下: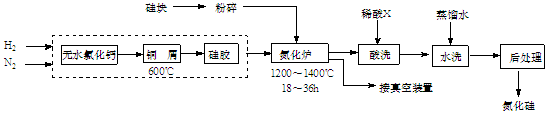
(1)净化N2和H2时,铜屑的作用是:;硅胶的作用是。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度:;体系中要通入适量的氢气是为了。
(3)X可能是(选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为:。
化合物A是来自石油的一种基本化工原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)。
已知: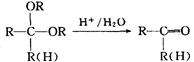
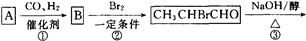
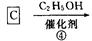
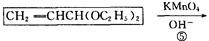

请回答下列问题;
⑴、写出有关物质的结构简式:A:;B:;C:;D:。
⑵、指出反应⑤的反应类型。
⑶、写出反应③的化学方程式。
⑷、反应④的目的是。
合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g) △H =-181.6kJ·mol-1。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
⑴比较此时正、逆反应速率的大小:v正v逆(填“>”、“<”或“=”)。
⑵若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) =mol·(L·min)-1。
⑶生产过程中,合成气要进行循环,其目的是。
化合物A、B、C、D、E分别由H+、Na+、Al3+、Cu2+四种阳离子和CO32-、Br-、SiO32-、SO42-四种阴离子组成。已知①A、B、C三种溶液pH<7,D、E溶液pH>7②A、C的阴离子相同,D、E的阳离子相同③用石墨电极电解A的溶液,阳极有无色气体产生,阴极有红色物质生成④C溶液与D溶液反应能生成一种白色沉淀和一种气体,且此沉淀可溶于B的溶液,此气体通入E的溶液中可产生另一种白色沉淀。
请根据以上事实填空:
⑴写出B、C、E的化学式:B___________、C___________、E____________。
⑵D溶液的pH>7,原因是:(结合离子方程式说明)__________________________________。
⑶写出C溶液与D溶液发生反应的离子方程式:_______________________。
⑷若用石墨电极电解400mL 1.0 mo1·L—1 A的溶液,当阳极有2.24 L气体(标准状况)产生时,溶液的pH=_______________(设溶液的体积不变)。