下列离子方程式正确的是
| A.氯气溶解于水:Cl2+H2O =HClO+Cl-+H+ |
| B.沸水中滴入饱和FeCl3溶液,溶液呈红褐色:Fe3++3H2O= Fe(OH)3↓+3H+ |
| C.醋酸钠溶液显碱性:CH3COO-+H2O =CH3COOH+OH-. |
| D.久置的H2S 溶液变浑浊:2S2-+O2+4H+ =2S↓+2H2O |
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是()
H++CH3COO-,下列叙述不正确的是()
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
下列溶液中有关物质的量浓度关系正确的是()
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +c(OH-) ==c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是()
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO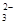 和OH- 和OH- |
| B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C.10 mL0.20mol·L-1CH3COOH溶液加入10 mL0.10mol·L-1的NaOH后,溶液中:c(CH3COO-)+c(CH3COOH)= 0.10mol·L-1 |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是()
| A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示。下列有关说法不正确的是()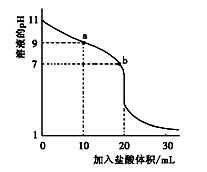
| A.b点:c(M+)+c(MOH)=c(Clˉ) |
| B.a到b点的水溶液导电性依次增强 |
| C.该一元碱溶液浓度为0.100 0 mol·L-1 |
| D.室温下,MOH的电离常数Kb=1×10-5 |