用密度为1.84g/mL,质量分数为98%的浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释 ④转移 ⑤洗涤 ⑥定容 ⑦摇匀
(1)所需浓硫酸的体积是 。
(2)第③步实验的操作是 。
(3)第⑥步实验的操作是 。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用字母填写a.偏高 b.偏低 c.无影响)
| A.所用的浓硫酸长时间放置在密封不好的容器中 |
| B.容量瓶用蒸馏洗涤后残留有少量的水 |
| C.所用过的烧杯、玻璃棒未洗涤 |
| D.量取浓硫酸时仰视量筒上的刻度取用浓硫酸 |
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(5)本实验最浪费时间的地方是将稀释后的硫酸冷却至室温,为了节约时间,简单易行的加
快稀硫酸冷却的方法是_____________________。
Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a。
(2)将装置C中两种液体分离开的操作名称是_________。装置D的作用是。
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水。I2+2S2O32-= 2I-+S4O62-
(1)用上述方法制取CaO2·8H2O的化学方程式是;
(2)检验“水洗”是否合格的方法是;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
①判断此滴定实验达到终点的方法是:。
②CaO2的质量分数为(用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
(填“不受影响”、“偏低”或“偏高”),原因是。
I、二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2: ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。
(2)一化学研究性学习小组设计用如下装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaC!:溶液,产生白色沉淀上述方案合理的是方案______(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子反应方程式为____________________。
③当通入二氧化硫至试管c中溶液显中性时,溶液中c(Na+)=________________(用含硫元素微粒浓度的代数式表示)。
Ⅱ、另一化学研究性学习小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:
电解时,粗铜应与电源的______极相连。阴极上的电极反应式为____________。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该反应的离子方程式:
____________________________________________________________。
(1)某厂利用生产磷铵排放的磷石膏废渣制硫酸联产水泥,硫酸返回用于生产磷铵。其生产流程图如下:
①操作b的名称是浓缩、冷却、。
②如反应II的产物是两种酸式盐,则物质B中溶质的化学式是。
③若在实验室中对反应II产生的气体用吸收。
④该生产流程最大的优点是尽可能地实现原料的循环使用和副产物的综合利用,该生产流程体现的基本思想是。
(2)为测定同体磷铵化肥中铵态氮的质量分数,实验室用下图所示装置进行实验。实验时,在A中加入mg磷铵样品,关闭止水夹a.打开止水夹b,向A中加入足量的浓NaOH溶液,完全反应后C中浓硫酸增重ng。请回答下列问题:
①试说明检查该装置气密性的操作方法和实验现象。
②装置B的作用是,装置D的作用是。
③实验过程应该在何时鼓入空气?答:(填“开始前”、“过程中”或“反应后”)
④如某次测定的铵态氮的质量分数明显偏低,则可能的原因是 (填字母)。
| A.磷铵样品与氢氧化钠未充分反应 | B.A和B中残留了一定量的氨气 |
| C.氢氧化钠溶液的浓度太大 | D.鼓气过快 |
⑤固体磷铵化肥中铵态氮的质量分数为。
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为
(2)两同学利用下图所示装置进行测定
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为、洗涤、干燥。
②装置E中碱石灰的作用是。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号)。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为。
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为: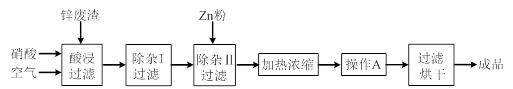
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.0 |
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ~。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的。