根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g) 2HI(g);△H=-9.48 kJ·mol-1
2HI(g);△H=-9.48 kJ·mol-1
(ii)I2(S)+ H2(g) 2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
| A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B.反应(i)的产物比反应(ii)的产物稳定 |
| C.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| D.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
1g氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,则()
| A.反应的热化学方程式:2H2(g)+O2(g)=2H2O(g) ΔH= +483.6 kJ·mol−1 |
| B.氢气的燃烧热为241.8 kJ·mol−1 |
| C.1 mol H2O(1)的能量大于1 mol H2O(g)的能量 |
| D.2 mol H2和1 mol O2的能量总和大于2 mol H2O(g)的能量 |
下列观点你认为正确的是()
| A.某单质固体能导电,该单质一定是金属 |
| B.某化合物的水溶液能导电,该化合物一定是电解质 |
| C.某化合物固态不导电,熔融态能导电,该化合物很可能是离子化合物 |
| D.某纯净物常温常压下为气体,则组成该物质的微粒一定含共价键 |
化学与生活是紧密相联的,下列说法正确的是()
| A.地震灾区用漂白粉消毒,是利用漂白粉溶液的碱性 |
| B.鱼、肉、鸡蛋等富含蛋白质的食品被称为碱性食品,长期缺乏可使尿液偏酸性 |
| C.生铁在潮湿的空气中易生锈,其负极反应式为2H2O+O2+4e—===4OH— |
| D.实验室储存的镁条着火时,不可以用泡沫灭火器灭火 |
X、Y、Z、W有如右图所示的转化关系,则X、Y可能是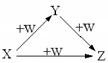
①C、CO②AlCl3、Al(OH)3
③Fe、Fe(NO3)2 ④Na2CO3、NaHCO3
A.①②③ B.①② C. ③④ D.①②③④
③④ D.①②③④
为鉴别K2CO3和NaHCO3两种白色固体,有五位同学为鉴别它们,分别设计了下列五种不同的方法,其中不可行的是()
①分别取样加入1mol/L的盐酸溶液,看有无气 泡产生
泡产生
②分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
③分别取样配成溶液,滴加BaCl2溶液,观察有无白色浑浊
④分别配 成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
⑤分别取样配成溶液,滴加澄清石灰水,观察有无白色浑浊
| A.①③⑤ | B.②④ | C.①⑤ | D.③ |