室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s) CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是
| A.ΔH2>ΔH3 | B.ΔH1+ΔH3=ΔH2 |
| C.ΔH1<ΔH3 | D.ΔH1+ΔH2>ΔH3 |
在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol·L—1 NaOH溶液之后,改成滴加C2mol·L—1盐酸,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示。则所加入NaOH溶液的体积为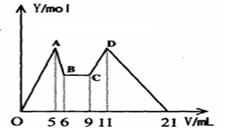
| A.6mL | B.7ml | C.7.5mL | D.9mL |
有关下图实验的描述正确的是
甲乙丙丁
| A.用甲图装置电解精炼铝 | B.用乙图装置制备Fe(OH)2 |
| C.丙图装置可制得金属锰 | D.丁图验证NaHCO3和Na2CO3热稳定性 |
已知常温下,在溶液中可发生如下反应:Ce4+ + Fe2+ = Fe3+ + Ce3+,
Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+。由此推断Fe2+ 、Ce3+、 Sn2+的还原性由强到弱的顺序是
| A.Fe2+ 、Ce3+、 Sn2+ | B.Sn2+、Fe2+ 、Ce3+ |
| C.Fe2+ 、Sn2+、Ce3+ | D.Ce3+、Fe2+ 、Sn2+ |
25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量,下列表示该反应的热方程式正确的是
A.CH4O(l)+ O2(g)==CO2(g)+2H2O(l);△H=-725.8kJ· mol—1 O2(g)==CO2(g)+2H2O(l);△H=-725.8kJ· mol—1 |
| B.2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l);△H=+1451.6kJ· mol—1 |
| C.2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l);△H=-22.68kJ· mol—1 |
D.CH4O(l)+ O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol—1 O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol—1 |
阿伏加德罗常数值是NA,标准状况下,若某氧气和氮气的混合气体mg含有b个分子,则
ng该混合气体在标准状况下的体积是
| A.22.4nb/mNA | B.22.4mb/nNA | C.22.4nNA/mb | D.nbNA/22.4m |