(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①25℃时,将20mL0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
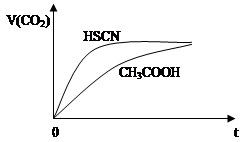
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________________.
反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
②若保持温度不变,,下列量会变小的是______________(填序号)
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)若往20mL0.1mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如右图所示,下列有关说法正确的是_______________。
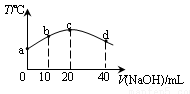
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
(16分)
I.某校化学实验小组探究浓度对化学反应速率的影响,并测定 和KI反应的化学反应速率。进行如下实验探究:
和KI反应的化学反应速率。进行如下实验探究:
【实验原理】 和KI反应的离子方程式为:
和KI反应的离子方程式为: (1)
(1)
平均反应速率的计算式为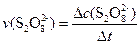 。
。
实验时,向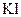 、
、 和淀粉指示剂混合溶液中加入
和淀粉指示剂混合溶液中加入 溶液,不断搅拌。
溶液,不断搅拌。
在反应(1)进行的同时,发生反应: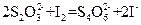 (2)
(2)
反应(1)生成的 立即与
立即与 反应,生成无色的
反应,生成无色的 和
和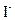 。
。 耗尽时,反应(1)继续生成的
耗尽时,反应(1)继续生成的 才与淀粉作用呈现蓝色。从加入
才与淀粉作用呈现蓝色。从加入 溶液到出现蓝色的时间为
溶液到出现蓝色的时间为 。
。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
|
| 试剂 用量 (mL) |
0.20 mol·L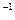 (NH4)2S2O8溶液 (NH4)2S2O8溶液 |
20.0 |
10.0 |
b |
20.0 |
20.0 |
0.20 mol·L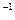 KI溶液 KI溶液 |
20.0 |
20.0 |
20.0 |
10.0 |
5.0 |
|
0.010 mol·L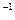 Na2S2O3溶液 Na2S2O3溶液 |
a |
8.0 |
8.0 |
8.0 |
8.0 |
|
| 0.2%淀粉溶液 |
2.0 |
2.0 |
2.0 |
2.0 |
2.0 |
|
0.20 mol·L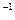 KNO3溶液 KNO3溶液 |
0 |
0 |
0 |
10.0 |
c |
|
0.20 mol·L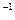 (NH4)2SO4溶液 (NH4)2SO4溶液 |
0 |
10.0 |
15.0 |
0 |
0 |
|
20℃时,反应时间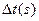 |
32 |
67 |
130 |
66 |
135 |
|
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 |
(2)为了使反应充分进行,减少数据误差,实验过程中应该不断进行的操作是。
(3)第①组实验的 mol·(L·s)
mol·(L·s)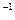 。
。
(4)根据上表数据分析,可以得到的结论有(写出一条即可)。
II.实验小组查资料得知,向含有NaCO3的Na2S溶液中通入SO2,可以制备上述实验所需的Na2S2O3。反应如下:


该小组根据上述原理设计如图19所示装置制备 。
。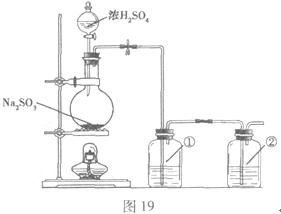
(1)实验应避免有害气体排放到空气中。装置①、②中盛放的试剂依次是①;②。
(2)实验过程中,随着气体的通入,装置①中有大量黄色固体析出,继续通入气体,可以观察到的现象是。
(3)反应结束后,从制得的 稀溶液中得到
稀溶液中得到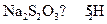 晶体的主要操作包括:。
晶体的主要操作包括:。
(14分)
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置如图18所示:
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的。
a.H2SO4 b.BaSO4 c.N2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是①;
② 。
。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
已知负极的电极反应是 。
。
①正极的电极反应是。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)L。
(12分)
A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图17 (反应条件和部分产物略去)。试回答:
(1)E的电子式是。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是。
(已知甲醇的燃烧热 ,氢气的燃烧热
,氢气的燃烧热 )
)
(16分)
有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。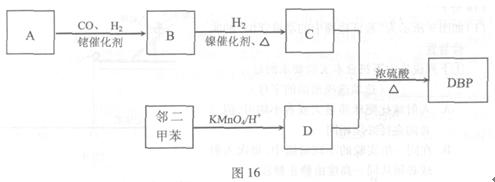
已知:① ;
;
②烃A是有机合成的重要原料。A的质谱图表明其相对分子质量为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物c的核磁共振氢谱显示其分子中含有5种氢原子,且其峰面积之比为3:2:2:2:1;DBP分子中苯环上的一溴取代物只有两种。
(1)A的结构简式是。
(2)B含有的官能团名称是。
(3)有机物C和D反应生成DBP的化学方程式是。
(4)下列说法正确的是(选填序号字母)。
a.A能发生聚合反应、加成反应和氧化反应
b.和C互为同分异构体,且含有相同官能团的有机物有2种
c.邻二甲苯能氧化生成D说明有机物分子中基团之间存在相互影响
d.1 mol DBP可与含2 mol NaOH的溶液完全反应
(5)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
①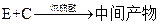 ②
②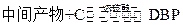
工业生产中在第②步中使用油水分离器将反应过程中生成的水不断从反应体系中分离除去,其目的是。
(6)工业上生产有机物E的反应如下: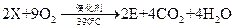
芳香烃X的一溴取代物只有两种,X的的结构简式是。
已知: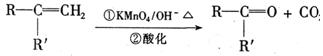
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5molA完全燃烧只生成3mol CO2和2.5molH2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成六 元环状酯类化合物。
元环状酯类化合物。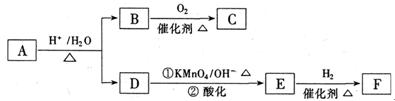
请回答:
(1)1mol B与足量的金属钠反应产生22.4L(标准状况)H2。B中所含官能团的名称是
。B与C的相对分子质量之差为4,B→C的化学方程式是。
(2)D的同分异构体G所含官能团与D相同,则G的结构简式可能是、。
(3)F可发生多种类型的反应。
①两分子F反应生成的六元环状酯类化合物的结构简式是;
②由F可生成使Br的CCl4溶液褪色的有机物H。F→H的化学方程式是。
③F在一定条件下发生缩聚反应的化学方程式是。
(4)A的结构简式是。