研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
【假设】H2O2生成O2的快慢与催化剂种类有关。
【实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
【进行实验】右下图是他们进行实验的装置图,气体发生装置中A仪器的名称是_____________,此实验中B处宜采用的气体收集方法是_______ _____。
【实验记录】
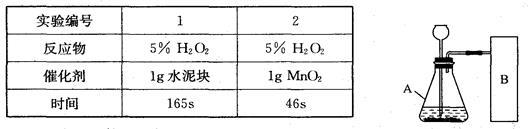
【结论】该探究过程得出的结论是_________________________。
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快。若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____ _____是否改变。
【实验拓展】H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
| 实验步骤 |
现 象 |
结 论 |
| 取一支试管加入3mL5%的过氧化氢溶液,然后加入少量二氧化锰。 |
缓慢有少量气泡冒出 |
|
| 另取一支试管加入3mL15%的过氧化氢溶液,然后加入少量二氧化锰。 |
迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
| 实验步骤 |
现 象 |
结 论 |
| |
|
温度越高,过氧化氢分解的速率越大 |
某研究性学习小组的同学在一次探究活动中,对一份纯碱样品(含有少量氯化钠)的纯度进行测定,请你参与并回答有关问题。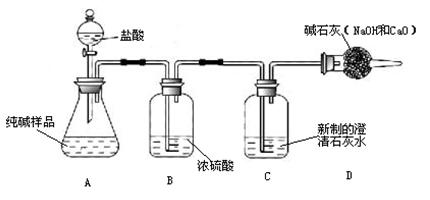
⑴ 甲同学进行如下操作:
① 组装好如图仪器,并检查___________ ;
② 取6.0g试样放入锥形瓶中,加入少量蒸馏水溶解,并在其他装置中加入相应的药品;
③ 称量盛有新制澄清石灰水的装置C的质量;
④ 打开分液漏斗旋塞滴入盐酸,直到不再产生气泡为止;
⑤ 再次称量装置C 的总质量;
⑥ 计算出样品中碳酸钠的质量分数。
⑵ 上图B装置的作用是______________; D装置的作用是__________________________。
【意外发现】C瓶中石灰水没有变浑浊,同学们感到惊奇并产生了探究的欲望。
【提出猜想】原因猜想:
①是生成的气体中混有盐酸挥发出来的HCl;
②是生成的气体流速太快,与石灰水反应产生了可溶性物质[经查资料分析可溶性物质是Ca(HCO3)2,它能与酸反应生成CO2等物质]。
【实验探究】
甲同学取少量实验后C瓶溶液于试管中,向其中依次滴加足量稀HNO3和AgNO3溶液,无气泡但有沉淀产生。据此判断只有猜想__(填“①”或“②”)成立。
【交流讨论】
对于如何改进实验,乙同学认为:应将盐酸换成稀硫酸,新制的澄清石灰水换成足量NaOH溶液;丙同学认为:应在装置A和B中间插入一个盛有饱和NaHCO3溶液的洗气装置以吸收HCl(CO2不溶于饱和NaHCO3溶液,也不与其反应),并将新制的澄清石灰水换成足量NaOH溶液 。
大家讨论后认为:乙同学的方案可行而丙同学的方案不可行。
【请你评价】
丙同学方案不可行的原因是。
【教师点拨】
即便换成稀硫酸和NaOH溶液,反应前后装置中存在的CO2也会使测定出的样品纯度不准确。
【请你改进】
在上述基础上,你的措施是。
同学们仍称取6.0g试样,用改进完善后的方案重新实验。
【数据处理】
装置C实验前后两次称量的质量差为2.2g,则样品的纯度为_。(列出计算过程)
【实验反思】
若不用上述方法,而用生成沉淀的方法来测定试样中纯碱的质量分数,可选用的试剂是。
(6分)某化学兴趣小组的同学设计了如图所示的装置,探究影响化学反应速率的因素。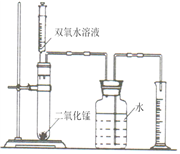
(1) 下图装置中使用注射器的优点是,观察量筒中液体的体积时视线要与。
(2)下面是用上述装置实验时,收集的相关数据:
| 实验 序号 |
H2O2溶液 的浓度/% |
H2O2溶液 的体积/mL |
MnO2的 用量/g |
温度/℃ |
收集O2的体积/mL |
反应所需 的时间/s |
| ① |
5 |
2 |
0.1 |
20 |
4 |
18 |
| ② |
10 |
2 |
0.1 |
20 |
4 |
6 |
| ③ |
30 |
8 |
/ |
40 |
2 |
64 |
| ④ |
30 |
8 |
/ |
60 |
2 |
25 |
由实验①和②对比可知.化学反应速率与 有关;
由实验③和④对比可知.化学反应速率与温度的关系是;
(3)化学反应的实质是构成物质的微观粒子相互碰撞、结合的结果.化学反应速率与微观粒子的概率有关。试从微观角度解释“反应物浓度越大,化学反应速率越快”的原因:
。
(4)发现问题:实验时温度最难控制,反应一段时间后溶液的温度总是比起始时温度高,说明反应
热量。
(5)继续探究:
除了该实验小组探究过的因素以外,你若还有其他影响反应速率的因素及探究方法.请写在下面。若正确.本题另奖励4分,本试卷总分不超过60分。
(10分)某市热电厂使用的燃料是含硫较多的煤.该厂附近一所中学的同学经常闻到空气有异味,且空气能见度差.学习化学后,同学们意识到这有可能是该厂排出的废气超标造成的,于是在老师的指导下做了探究实验,请你填写下列空白,
【提出问题】该厂附近所降雨水是否是酸雨?空气里SO2是否超标呢?
【查阅资料】I.我国关于SO2在风景区、居民区、工厂区的空气质量最高标准分别见下表:
Ⅱ.硫酸钡既不溶于水,也不溶于酸(如不与稀盐酸、稀硝酸等反应).
【设计实验1】第一组同学取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔几分钟测一次pH,其数据如下表所示:
所降雨水(填“是”或“不是”)酸雨。在测定时间内酸雨pH减小的原因可能是__
【设计实验2】第二小组同学设计以下步骤来测定空气中SO2的含量.
(1)用2L的空可乐瓶采集工厂附近的空气样品,采样的具体操作是:
(2)向取回的装有空气样品的可乐瓶中倒入NaOH溶液,盖紧瓶塞后充分振荡,仿照CO2与NaOH溶液的反应,写出SO2与NaOH溶液反应的化学方程式:
(3)加入一定量氧化剂H2O2,使其中Na2SO3完全转化为Na2SO4.向可乐瓶中加入过量的BaCl2溶液.Na2SO4和BaCl2反应的化学方程式为:____
(4)经过过滤、洗涤、烘干,称量固体质量为1.165mg.
计算:1.165mg硫酸钡中硫元素的质量为mg.由质量守恒定律可知,2L空气样品中SO2的质量为mg.
由空气质量标准可得出结论:该厂排放的SO2严重超标.。
【发现新问题】考虑到空气中的各种气体成分,第一组认为第二组同学的SO2的含量偏大,其依据是;你提出的实验改进方案是
【反思与应用】为尽快改善该地区的空气质量,请你提出一条合理化建议:
目前,废旧电池对环境的污染已越来越引起人们的重视。为了实现可持续发展的战略目标,许多有识之士正在研究废旧电池的有效回收再利用
技术。右图为普通电池(锌锰电池)示意图,请你根据图示
分析回答:
(1)废旧电池内含有的一种有机物名称是____。
(2)小李同学想得到⑤中纯净干燥的二氧化锰和氯化铵溶
液,并检验氯化铵中的铵根离子。设计了如下实验,
请回答:
实验①玻璃棒的作用是
实验②过滤后,滤液仍然浑浊,则造成浑浊的原因可能(填编号)
| A.滤纸破损 | B.过滤过程中滤液的液面超过了滤纸的边缘 |
| C.烧杯不干净 | D.滤液C中的物质相互反应 |
实验③灼烧的目的是
实验④的反应方程式
(3)氯化铵中的铵根离子检验方法:用小试管取少量滤液,滴加氢氧化钠溶液,微热,用试纸放在试管口,如果变蓝,则证明滤液中含有铵根离子。反应方程式为
优质珍珠粉和廉价“珍珠粉”价格相差很大,但外观、手感没有明显差异,某化学兴趣小组同学对二者成分的不同进行了探究。
【查阅资料】
①优质珍珠粉由珍珠加工而成,含有一定量的碳酸钙、氨基酸等;氨基酸大部分能溶解于水,遇到浓硝酸并加热会呈现黄色或黑色。
②廉价“珍珠粉”由贝壳加工而成,加工过程中会用到氢氧化钠;贝壳的主要成分是碳酸钙。
③优质珍珠粉和廉价“珍珠粉”中,除碳酸钙外,其他成分均不能与盐酸反应生成二氧化碳。
【提出猜想】优质珍珠粉和廉价“珍珠粉”的区别可能有:
①廉价“珍珠粉”中含有。
②廉价“珍珠粉”中不含氨基酸。
③优质珍珠粉和廉价“珍珠粉”中碳酸钙的质量分数不同。
【实验Ⅰ】将少量优质珍珠粉和廉价“珍珠粉”分别放入两只烧杯中,加少量水溶解,静置一段时间后过滤,取两种滤液备用。
| 操作 |
现象 |
结论 |
| 取少量两种滤液分别于两支试管中,滴加少量 |
优质珍珠粉的滤液没有变色;廉价“珍珠粉”的滤液变红 |
猜想①成立 |
| 取少量两种滤液分别于两支试管中,加入一定量,加热至沸腾 |
优质珍珠粉的滤液有黄色出现,局部变黑;廉价“珍珠粉”的滤液没有明显现象 |
猜想②成立 |
【实验Ⅱ】将10.00g优质珍珠粉和廉价“珍珠粉”分别放入两只烧杯中,逐滴加入稀盐酸,边滴加边振荡,直至恰好完全反应。数据记录如下:
| 优质珍珠粉 |
廉价“珍珠粉” |
|
| 固体粉末的质量 |
10.00 g |
10.00 g |
| 加入稀盐酸的质量 |
46.00 g |
50.13 g |
| 反应后烧杯中物质的质量 |
52.00 g |
55.77 g |
数据处理:通过上表数据计算廉价“珍珠粉”中碳酸钙的质量分数。
(请写出计算过程,结果保留至0.1%)
得出结论:廉价“珍珠粉”中碳酸钙的质量分数优质珍珠粉(选填“高于”、“低于”或“等于”)。
【反思与评价】已知实验Ⅱ中所用稀盐酸的质量分数为14.6% 。小明提出:用加入稀盐酸的质量乘以其质量分数,求出参加反应的氯化氢的质量,进而利用化学方程式也能求出廉价“珍珠粉”中碳酸钙的质量。你认为小明的思路是否可行?(选填“可行”或“不可行”)。你的理由是。