实验室制取氧气的反应为2KClO3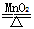 2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)
2KCl+3O2↑,反应后从剩余物中回收纯净的二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)
| A.溶解、过滤、蒸发、洗涤 | B.溶解、过滤、洗涤、干燥 |
| C.溶解、蒸发、洗涤、过滤 | D.溶解、洗涤、过滤、加热 |
苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:C6H5C2H5(g) C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),下图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是
C6H5CH=CH2(g)+H2 (g),实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),下图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系。下列说法正确的是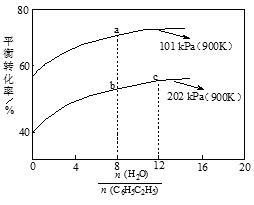
| A.a、b两点转化率不等,但是化学平衡常数相等 |
| B.b点转化率为50%,则混合气体中苯乙烯的体积分数为1/3 |
| C.恒容时加入稀释剂(水蒸气)能减小C6H5C2H5平衡转化率 |
| D.b点和c点温度和压强相同,故其反应速率也相等 |
普通锌锰干电池的简图(下图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽。在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O
关于锌锰干电池的下列说法中正确的是
| A.当该电池电压逐渐下降后,利用电解原理能重新充电复原 |
| B.电池负极的电极反应式为:2MnO2+2NH4++2e- = Mn2O3+2NH3+H2O |
| C.该电池碳棒可用铜棒代替,但是工作电压会下降 |
| D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5g |
某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l)△H=-273kJ·mol-1
②NO2-(aq)+1/2O2(g)=NO3-(aq)△H=-73kJ·mol-1
下列说法正确的是( )
| A.1mol的NH3和1mol的NH4+都有10×6.02 ×1023个质子 |
| B.室温下,NH4NO2溶液呈酸性,则说明Ka(HNO2)< Kb(NH3·H2O) |
| C.NH4+(aq)+2O2(g)NO3—(aq)+2H+(aq)+H2O(l);△H=" -" 346kJ/mol |
| D.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
某含Na+的溶液中可能含有Al3+、NH4+、Fe3+、CO32-、I-、SO32-。取样,滴加足量氯水,有气泡产生;继续向溶液中加BaCl2溶液或淀粉均无现象。为确定该溶液的组成,还需进行的实验有
| A.取样,滴加硫氰化钾溶液 |
| B.取样,加足量的浓NaOH溶液加热,用湿润的红色石蕊试纸检验气体 |
| C.取样,逐滴滴入氢氧化钠溶液直至足量 |
| D.取样,加足量盐酸加热,湿润的品红试纸检验气体 |
下列离子反应中,表达正确的是
| A.向AlCl3溶液中加入过量氨水:Al3+ + 4 NH3·H2O = AlO2- + 4 NH4+ + 2 H2O |
| B.用FeCl3溶液溶解废铜中的铜:2Fe3+ + 3Cu = 3Cu2+ +2 Fe |
| C.NaHCO3溶液中滴入过量的Ba(OH)2溶液:HCO3-+Ba2++OH-= BaCO3↓+ H2O |
| D.铝片溶于过量的氢氧化钠溶液中:Al + 4OH- = AlO2- + 2H2O |