【化学——选修3:物质结构与性质】(10分) 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价电子(外围电子)排布式为_______________________。
(2)硝酸钾中NO3-的空间构型为____________________,写出与NO3-互为等电子体的一种非极性分子化学式_______________。
(3)6氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有____________。
(4)下列说法正确的有______________(填字母序号)。
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(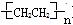 )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)===SiO2(s)中,每生成60 g SiO2放出的能量为(2c-a-b) kJ
| 化学键 |
Si—Si |
O==O |
Si—O |
| 键能(kJ·mol-1) |
a |
b |
c |
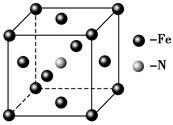
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式________________。若两个最近的Fe原子间的距离为s cm,则该晶体的密度是____________g·mol-1。

(8分)某种橡胶分解产物为碳氢化合物,对这种碳氢化合物进行以下实验:
①若取一定量的橡胶完全燃烧,燃烧后的气体通过干燥管,干燥管增重0.72 g,再通过足量的石灰水,石灰水增重2.2 g。
②经测定,该碳氢化合物(气体)的密度是相同状况下氢气密度的34倍。
③该碳氢化合物0.10 mol能和32 g溴起加成反应,经分析,产物中溴原子分布在不同的碳原子上,且溴代物中有1个碳原子在支链上,试推断:
(1)该碳氢化合物的结构简式是____________,名称是___________。
(2)该橡胶的结构简式是______________________,名称是______________________。
(6分)环氧树脂塑料具有高度黏合力、加工性能好、耐化学腐蚀等特点,其结构简式为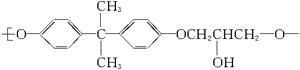
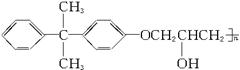
它由2种单体通过缩聚反应而成,已知一种单体是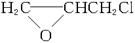 ,则另一种单体的结构简式是:________________________________________。
,则另一种单体的结构简式是:________________________________________。
用化学方程式表示上述2种单体通过开环加聚和缩合加聚生成环氧树脂的过程__________。
汞蒸气有毒,(1)万一把汞洒出,可以在溅洒有细微汞滴的部位撒一层硫磺粉,这里发生的反应的化学方程式是
___________________________________________________________。
(2)室内有汞蒸气时应进行通风以降低汞蒸气的浓度,这时通风口装在墙的___________(上、下)部效率好。
过氧化氢(H2O2)俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
(1)写出H2O2的电子式______________________。
(2)你认为H2O2被称为“绿色氧化剂”的主要原因是:_______________________________。
(3)将Cu放入稀硫酸中不发生反应,但再加入H2O2后,则Cu被溶解。写出离子反应方程式_______________________________________________________。
工业上用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,需把浓硝酸用等体积的水稀释。试简要完成下列问题:
(1)用稀硝酸而不用浓硝酸的原因是_______________________________________________。
(2)从经济效益和环境保护角度考虑,设计制取硝酸铜最适宜的方法,用化学方程式表示为__________________________。