已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。请用右图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系。实验测得数据和有关结果如下:
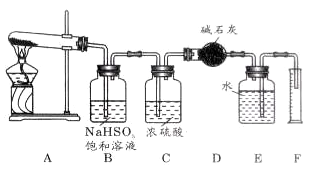
①准确称得无水硫酸铜 2.4 g;
②测出量筒中水的体积,折算成标准状态下气体的体积为112 mL;
③干燥管在实验后质量增加1.28 g;
④实验结束时装置B中的NaHSO3溶液变为Na2SO4溶液(不含其他溶质)。
请回答下列问题:
(1)装置B的作用是_________________ ;发生的化学方程式___________________。
(2)装置C的作用是_______________________;干燥管收集到的物质是__________ 。
(3)装置E和F的作用是________________________________;
(4)实验数据测出后,首先应计算出的物质是_________,有________mol;并据此计算出SO2为_________mol,SO3为___________mol。
化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据合理的是________(填序号)。
a.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
b.用干燥的pH试纸测定浓硫酸的pH
c.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
(2)某废水样品中含有一定量的Na+、CO32-、SO32-,某研究小组欲测定其中SO32-的浓度。
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol/L KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,计算。
①下列滴定方式中,最合理的是(夹持部已分略去)______(填字母序号)。
②滴定过程中,有关反应的离子方程式是__________________________________。
(3)某同学制备Fe(OH)3胶体:用洁净的烧杯取适量蒸馏水加热至沸腾,向烧杯中滴加 1 mol/L的FeCl3溶液,并不断用玻璃棒搅拌,结果溶液变浑浊。该同学制备胶体失败的原因是 ,你认为成功制得Fe(OH)3胶体的特征现象是_________。
(4)用下图装置进行CO2性质的有关实验。
试剂瓶B中盛有饱和NaHCO3溶液,其目的是:
_________________________________。
②反应过程中,E中澄清石灰水变浑浊,E中的混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系:
_______________________________。
(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是________(填写编号)。
①用pH试纸测定Na2CO3溶液的pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)用“大于”、“小于”或“等于”填空:
①读取量筒中液体的体积时,视线偏高,读取的体积数________实际体积数。
②用托盘天平称取10.4 g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量_____10.4 g。
③配制500 mL 0.1 mol/L NaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓度 _______0.1 mol/L。
④用中和滴定法测某NaOH溶液的浓度,量取待测液时未用该溶液润洗滴定管,测得的溶液浓度________实际浓度。
某学生应用下图所示的装置来研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气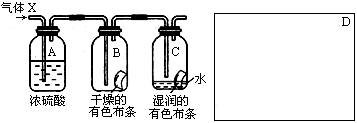
回答下列问题:
(1)该项研究(实验)的主要目的是。
(2)浓H2SO4的作用是,与研究目的直接相关的实验现象是。
(3)该实验装置设计上存在的缺陷为,请在上图的D处画出能克服该缺陷的装置。
用18.4mol·L-1的浓H2SO4配制100mL浓度为1mol·L-1的H2SO4溶液,其操作可分为以下各步:
| A.用量筒取 mL浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌 |
| B.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液都倒入100mL容量瓶里 |
| C.将稀释后H2SO4溶液小心倒入100mL容量瓶里 |
| D.检查100mL容量瓶口部是否会发生滴漏 |
(E)将蒸馏水直接加入容量瓶,至液面接近环形刻度线 处
(F)盖紧瓶塞,反复颠倒振荡,摇匀溶液
(G)用 向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切
据此填写:(1)上述各步的空白处。
(2)正确的操作顺序是(字母填写) 。
(3)进行A步操作应选择下列量器:①10mL量筒;②50mL量筒;500mL量筒;④1000mL量筒中的(填序号) 。
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用:________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:
(2)球形干燥管C的作用是反应前向D中加入几滴酚酞,反应结束后D中的现象是。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)_________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷B.碱石灰C.无水硫酸钠 D.生石灰