下列实验操作中数据合理的是
| A.用10 mL 量筒量取5.2 mL盐酸 |
| B.用pH试纸测得某溶液的pH值为12.5 |
| C.用托盘天平称取25.12gNaCl固体 |
| D.用100 mL容量瓶配制50mL0.1 mol/L的盐酸 |
接触法制硫酸通常在400~500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3。2SO2(g)+O2(g) 2SO3(g)△H<0,在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件获得SO3 ,采取加压措施的目的
2SO3(g)△H<0,在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件获得SO3 ,采取加压措施的目的
| A.发达国家电能过量,以此消耗大量能源 |
| B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率 |
| C.加压可使SO2全部转化为SO3 ,消除SO2对空气的污染 |
| D.高压有利于加快反应速率,提高生产效率 |
在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
| A.平衡向正反应方向移动了 | B.平衡向逆反应方向移动了 |
| C.物质B的质量分数增加了 | D.a<b |
一定温度下,在一容积固定的密闭容器中,建立了下列平衡:2NO2 N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
| A.减少 | B.增大 | C.不变 | D.无法判断变化情况 |
25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是:
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应 |
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是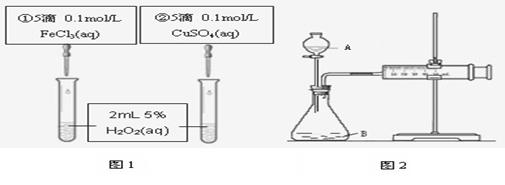
| A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间 |
| D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 |