HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是______________(填序号)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是______________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________________。
(4) Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是___________(填序号)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2∶1,试配平下列方程式:
FeSO4+K2O2——K2FeO4+K2O+K2SO4+O2↑
(6)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是__________________。
A、B、C、D、E五种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
A.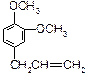 B.
B. C.
C.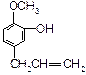 D.
D. E.
E.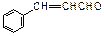
请回答下列问题:
(1)这五种化合物中,互为同分异构体的是(写编号)。
(2)D中含有的官能团是(写结构简式):
有总物质的量一定的甲烷和某有机物A(分子式为CaHbOc,a≥1、c≥1、b为正整数)的混合物。
(1)若混合物中甲烷和A不论以何种比例混合,其完全燃烧所生成的水的物质的量不变,则A的组成必须满足的条件是;符合此条件的A中,相对分子质量最小的A的分子式为。
(2) 若混合物中甲烷和A不论以何种比例混合,其完全燃烧所消耗的氧气和生成的水的物质的量均不变,符合此条件的A中,相对分子质量最小的A的分子式为。
(3) 若有机物CxHy(x、y为正整数)和CaHbOc(a≥x)不论以何种比例混合,只要混合物的总物质的量一定,完全燃烧时所消耗的氧气和生成的水的物质的量均不变,那么,这两种有机物的组成必须满足的条件是(用含x、y、a、b、c等的代数式表示)
。
煤的“气化”是使煤变成洁净能源的有效途径之一,其主要反应为:C + H2O CO + H2下图是用煤为原料合成F的路线图(部分反应条件和生成物已略),D的分子式为C9H10O,且能发生银镜反应。
CO + H2下图是用煤为原料合成F的路线图(部分反应条件和生成物已略),D的分子式为C9H10O,且能发生银镜反应。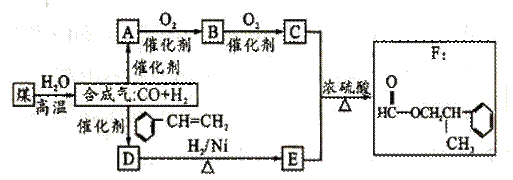
(1)写出A、D的结构简式:A:_______________ D:________________
(2)关于有机物F的说法正确的是。
A.属于芳香烃 B.能够发生银镜反应
C.1molF最多可以加成4molH2 D.易溶于水
(3)写出C与E反应生成F的化学方程式:_________________________________________
(4)“合成气” (CO、H2)除作合成有机物的原料外,还有其他用途,如_______ (举一例).
(5) F有多种同分异构体,满足下列条件的同分异构体有 _____ 种(不包括F).
①属于酯类, 且能发生银镜反应
②苯环上的一氯代物只有两种.
③分子中只有两个甲基.
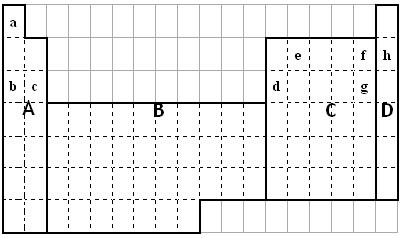
(1)在元素周期表上述四个区域中,单质均能导电的是 。
(a)A(b)B(c)C(d)D
(2)最外电子层只有圆球形电子云的主族元素在区域 中。
(a)A(b)B(c)C(d)D
(3)e形成的单质晶体可能为。
| A.离子晶体 | B.分子晶体 | C.原子晶体 | D.金属晶体 |
(4)元素非金属性强弱比较有很多方法,其中f和g的非金属性强弱的研究方案中不可
行的是_________(填序号);
①比较两种单质的颜色②比较氢化物的稳定性
③依据两元素在周期表的位置④比较原子半径大小
⑤比较最高价氧化物对应水化物的酸性
(5)请用一个化学方程式来说明b的金属性比d强
_____________________________________________________________________
现有部分短周期主族元素的描述如下表:
| 元素编号 |
元素描述 |
| W |
人体内含量最多的元素,且其单质是常见的助燃剂 |
| X |
第三周期中半径最小的元素 |
| Y |
原子核外最外层电子排布为nsnnpn |
| Z |
原子的最外层p亚层电子数等于次外层电子数 |
(1)元素W的原子的电子排布式:____________________
(2)元素X离子的电子式:。
(3)元素Y的原子核外有种电子云形状。
(4)元素Z的氢化物充分燃烧后,产生Z的氧化物与水的物质的量之比为2,
写出其中两种氢化物的名称、,
(5)X、Z元素的最高价氧化物对应水化物的酸性强弱:>
(用化学式表示)。