【2015年四川省成都市】(9 分)自来水厂净水过程的主要操作流程如下图:

资料:常用的絮凝剂有明矾[KAl(SO4).12H2O],消毒剂有液氯(Cl2)
回答下列问题:
(1)操作X 的名称是 ,试剂A 的名称是 。
(2)明矾作絮凝剂是因为与水反应生成氢氧化铝胶状物。氢氧化铝的化学式为 。
液氯与水中杂质反应生成一些对人体有害的物质,例如三氯甲烷(CHCl3).三氯甲烷属于_______(填“有机物”或“无机物”)
(3)高铁酸钾(K2FeO4)能作消毒剂与絮凝剂。它杀菌时会生成氢氧化铁胶状物。高铁酸钾中铁元素的化合价是 。
(4)硫酸铝也能做絮凝剂,写出制取硫酸铝反应的化学方程式________________________
(5)自来水厂的净水过程 (填“能”或“不能”)将硬水软化成软水,生活中将硬水软化的方法是 。
晓敏同学对餐桌上加热食物的某种白色固体燃料产生了浓厚的兴趣,于是她进行了以下探究活动。请你一起参与她的探究过程吧!
【猜 想 一】 固体燃料是固态的酒精吗?
【资 料 一】 酒精,学名乙醇,熔点为-114.1℃,沸点为78.5℃,易溶于水,能与水以任意比互溶。
【得出结论1】根据资料一,你认为常温下酒精的状态是。
【提出问题】 固体燃料可能含有哪些元素?
【资 料 二】
① CuSO4+ 5H2O = CuSO4·5H2O
无水硫酸铜是白色固体五水合硫酸铜是蓝色固体
NaOH溶液可以用来充分吸收二氧化碳气体。
2NaOH + CO2 = Na2CO3 + H2O
【得出结论2】根据资料二,白色的无水硫酸铜遇到水变成色。
【实验探究】
如下图所示,晓敏同学取适量固体燃料置于某装置中,用火柴点燃,并将燃烧产生的气体依次通过以下装置。固体燃料燃烧后,有少量固体残余。
【实验现象】
①A中白色固体部分变蓝,说明燃烧的生成物中有,可知固体燃料中一定含有元素。
②B中澄清石灰水变浑浊,说明燃烧的生成物中有二氧化碳,写出B中发生反应的化学方程式。可知固体燃料中一定含有元素。
③C、D中无明显变化,说明燃烧生成的二氧化碳已被完全吸收。
④E中黑色的氧化铜逐渐变红,F中澄清石灰水变浑浊, 说明燃烧的生成物中还含有的物质是。
【实验结论3】根据以上实验事实,晓敏认为该白色固体燃料中肯定含有氧元素。你认为晓敏的判断是否合理,理由是
。
实验室常用加热(85℃)NH4Cl和NaNO2两种饱和溶液的方法制取N2,下图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题:
【查阅资料】:
1、NH4Cl和NaNO2反应生成NaCl、H2O及N2,并放出大量热量;
2、20℃时,NH4Cl的溶解度约为37g;
3、N2难溶于水,实验条件下,密度为1.25g·L—1。
【实验步骤】:
①;
②20℃时,取0.78g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为V mL;
⑦处理剩余药品,整理实验台。
【实验分析及数据处理】:
(1)写出装置中仪器的名称:a、;b、;
(2)反应的化学方程式为:;
(3)完善实验步骤中的所缺部分:①;
(4)步骤④中,移走酒精灯的目的是;
(5)NH4Cl是一种(填“易溶”、“可溶”、“微溶”、“难溶”)物质。20℃时,其饱和溶液中溶质质量分数为。根据实验数据计算,生成氮气约为多少毫升?(3分,计算过程中,中间数据保留2位小数,最终结果为整数;相对分子质量:Mr-NH4Cl:53.5、Mr-N2:28)
(6)根据计算结果,步骤⑥中V的数值为;
(7)实验中,实际测得氮气的体积偏大,可能原因是。
A.实验中加入饱和NaNO2溶液的体积也被作为生成N2的体积
B.装置漏气
氮气是一种重要的工业原料,广泛应用于化肥等工业。工业常用PSA变压吸附制氮气,某学习小组查阅到相关制氮气工艺流程,并展开学习,请回答相关问题:
【资料】:
1、碳分子筛对不同气体的吸附强度不同,如图所示;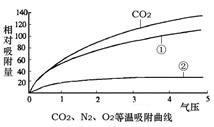
2、气压越大,碳分子筛吸附能力越强,反之越弱;
3、碳分子筛可以再生,能重复使用。
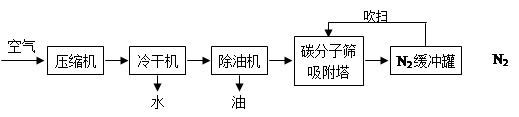
(1)吸附塔中碳分子筛具有吸附性,这种性质是(填“化学”、“物理”)性质,根据工艺流程,资料1图像中气体②是(填化学式);
(2)根据资料,碳分子筛再生的方法是。
(3)相比分离液态空气制氮气,该工艺的优点是;
(4)氮气可作食品保护气,是因为氮气化学性质(填“稳定”、“活泼”)。N2和H2在500℃、200MPa及催化剂的条件下发生反应,生成NH3,反应的化学方程式为,反应中,N2和H2的质量比为。
新课标化学教材九年级上册(2012教育部审定)“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 |
实验现象 |
| Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 |
A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 |
试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
|
| Ⅳ分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
【实验结论】
(1)A中产生的气体是;
(2)实验Ⅱ、Ⅲ证明:氧化铁的和在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的化学方程式。
【实验评价】
实验设计Ⅳ的目的是;
若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是。
【实验拓展】
查阅资料得知,CuO、CuSO4、、、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。
下列有关催化剂的说法中正确的是。
MnO2只能作过氧化氢溶液分解的催化剂
同一个化学反应可以有多种催化剂
催化剂只能加快化学反应的速率
用作催化剂的物质不可能是其他反应的反应物或生成物
酶是一种重要的生物催化剂,它属于糖类
【拓展计算】如果需制备氧气9.6克,至少需要5%过氧化氢克。
某化学兴趣小组对一包干燥的红色粉末组成进行探究。请你参与并回答问题。
【教师提醒】它由Cu 、Fe2O3两种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成,
猜想①:只有Cu;猜想②:只有;猜想③:是Cu 、Fe2O3的混合物
【实验探究】
同学们为确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右下图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,继续通CO气体直至玻璃管冷却。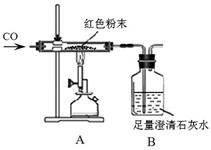
(1)在装置A中先通CO气体的目的是 。A装置中发生反应的化学方程式;实验中观察到A装置中的现象为。
(2)反应前后称量相关装置和物质的总质量,其数据如下表:
| 反应前 |
反应后 |
| 玻璃管和红色粉末的总质量为37.3 g |
玻璃管和固体物质的总质量为36.1 g |
小蒋同学初步分析表中的数据后,马上得出猜想(填“①”“②”“③”)肯定不正确,理由是。
(3)小林同学认为为了防止溶液倒吸,本实验停止加热前应先断开A和B的连接,你认为是否需要?(填“需要”或“不需要”),理由是。
【反思评价】实验后小组内有同学指出:上图装置未进行尾气的处理。于是有同学设计了用右图装置代替原装置,则C装置的作用有 、 (至少答两点)。