根据下列装置图,回答有关问题:

(1)写出装置图中标号仪器的名称:a____________;b____________。
(2)写出实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式:__________________________。可选用的收集装置是________(填字母)。
(3)写出实验室用石灰石和稀盐酸反应制取二氧化碳的化学方程式_________________________。可选用的发生装置是________(填字母)。
(4)实验室将A装置加以改动,在高温下使碳酸钙分解生成氧化钙和二氧化碳。按此反应,试计算工业上要制取5.6t氧化钙,理论上需要含碳酸钙80%的石灰石的质量是多少?(写出计算过程)
有一包白色固体可能含氯化钠、碳酸钙、硝酸铵、氯化钡和硫酸钠中的一种或几种,实验小组设计如下实验方案,检验白色固体的成分(假设实验中每一步均恰好完全反应)。

回答下列问题:
(1)a处的操作是 。
(2)气体A的化学式是 。
(3)硝酸铵在农业上常用作 肥。
(4)若固体C中加入稀硝酸,有一部分溶解则原粉末的成分中一定有 。
(5)若固体C中加入稀硝酸,固体不溶解,写出生成固体C的化学反应方程式 ,化学反应基本类型为 。
金属材料与人类的生产、生活密切相关。
(1)大自然向人类提供了丰富的金属矿物资源,其中提取量最大的是铁。工业上利用赤铁矿石炼铁的原理是 (用化学方程式表示)。实验室用的铁架台是铁的合金制成,合金比纯的金属硬度、强度更高, 也更好。用久的铁架台有一些出现锈迹,学校要对这些铁架台进行除锈,防锈处理,写出除去铁锈所发生的化学反应方程式 ,从实际考虑,学校应对这些除锈后的铁架台做 的防锈处理。
(2)为了比较铜、锌、铁三种金属的活动性强弱,可以将打磨光亮的两根铁丝分别插入 的溶液中,能判断出三种金属的活动性由强到弱的顺序是 。
随着人们生活水平的提高,汽车已经走进千家万户.
(1)在汽车电路中,经常用铜做导线,这是利用铜的延展性和 性.
(2)车体多用钢材制造,钢铁厂用赤铁矿为原料炼铁的原理是(用化学方程式表示) .
(3)为减少汽油燃烧产生的废气对环境的污染,我国开发推广使用一种车用乙醇汽油,其中含乙醇10%.请写出乙醇在空气中完全燃烧的化学方程式 .
对知识的归纳和总结是学习好化学的重要方法。在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图所示),即氢氧化钙与图中四类物质能够发生化学反应。
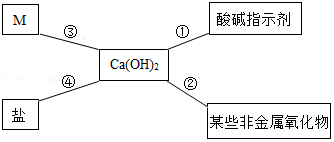
(1)图中M所属的物质类别是 。
(2)氢氧化钙可由生石灰和水反应制得,该放应能 (填"吸收"或"放出")热量。
(3)利用图中氢氧化钙能与 反应的性质,可以解释"用石灰浆粉刷墙壁,干燥后墙壁就变硬了"的现象。
(4)利用图中④氢氧化钙和盐反应的性质,除去氢氧化钠溶液中少量的氢氧化钙杂质。请写出该反应的化学方程式 。
金属材料是重要的资源,在日常生活中已经得到越来越广泛的应用。
(1)将铝片和硬铝片相互刻画,铝片上留下明显的划痕,说明 。
(2)沙漠地区的铁制品锈蚀较慢,其原因是 。
(3)为了比较铁、铜、银三种金属的活动性顺序强弱,某同学设计了下列四种方案:
①将铁丝、银丝分别浸入硫酸铜溶液中;②将银丝分别浸入到硫酸亚铁、硫酸铜溶液中;
③将铜丝、银丝分别浸入到硫酸亚铁溶液中;④将铜丝分别浸入到硫酸亚铁、硝酸银溶液中其中可行的方案是 (填序号)。可行方案中发生的基本反应类型为 。
(4)工业上将赤铁矿石冶炼成铁是一个复杂的过程。炼铁高炉中发生的主要反应有:
①高温下一氧化碳将铁矿石还原为铁;②高温煅烧石灰石;③灼热的焦炭和二氧化碳的反应;④焦炭充分燃烧,其中体现焦炭作用的反应是 (填序号)。