氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解:CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关它的推断中错误的是:
| A.“另一种反应物”一定只具有氧化性 |
| B.“另一种反应物”一定具有还原性 |
| C.点燃时:2CuH+3Cl2=2CuCl2+2HCl |
| D.CuH 既可做氧化剂也可做还原剂 |
用食用白醋(醋酸浓度约1 mol•L-1)进行下列实验,能证明醋酸为弱电解质的是()
| A.白醋中滴入石蕊试液呈红色 | B.白醋加入豆浆中有沉淀产生 |
| C.蛋壳浸泡在白醋中有气体放出 | D.pH试纸显示白醋的pH为2~3 |
某温度下,反应SO2(g)+ 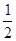 O2(g)
O2(g)  SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)  2SO2(g) + O2(g)的平衡常数K2的值为()
2SO2(g) + O2(g)的平衡常数K2的值为()
| A.2500 | B.100 | C.4×10-4C | D.2×10-2 |
某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g) 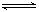 cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是()
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是()
| A.平衡正移 | B.(a+b)>(c+d) |
| C.Z的体积分数变小 | D.X的转化率变大 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是()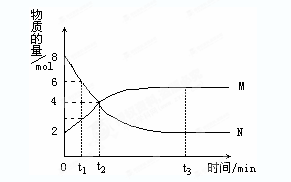
A.反应的化学方程式为:2M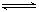 N N |
B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 | D.t1时,N的浓度是M浓度的2倍 |
某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1、c(Z)=0.4mol·L-1,则该反应的反应式是()
A.X2+2Y2 2XY2 2XY2 |
B.2X2+Y2 2X2Y 2X2Y |
C.3X2+Y2 2X3Y 2X3Y |
D.X2+3Y2 2XY3 2XY3 |